
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1=-159.47kJ/mol K1
NH2COONH4(s) △H1=-159.47kJ/mol K1
反应II:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3 K3
CO(NH2)2(s)+H2O(g) △H3 K3
请回答下列问题:
(1)①总反应的△H3=_______kJ/mol。该热化学方程式的平衡常数K3=____________(用K1、K2表示)。
②反应I一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列不能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2)
D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)。
(2)在体积可变的恒压(p总)密闭容器中充入1 mol CO2 与足量的碳,让其发生反应:C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。

①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“=”);若充入等体积的CO2 和CO,平衡________移动(填“正向”“逆向”或“不”)。
②650℃,CO2 的转化率为_____________。
③已知:气体分压(P分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡常数,925℃时,Kp=_____________ (用含P总的代数式表示)。
【答案】 -86.98 K1·K2 低温 AC 否 > 不 25% 23.04P总
【解析】(1)①反应Ⅰ:2NH3(g)+CO2(g)NH2CO2NH4(s)△H1=-159.47kJ/mol,反应Ⅱ:NH2CO2NH4(s)CO(NH2)2(s)+H2O(g)△H2=+72.49 kJ/mol,总反应:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)△H3,由盖斯定律总反应=反应I+反应Ⅱ,得到2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3 =-86.98 kJ/mol,该热化学方程式的平衡常数K3= K1·K2,故答案为:-86.98;K1·K2;
CO(NH2)2(s)+H2O(g) △H3 =-86.98 kJ/mol,该热化学方程式的平衡常数K3= K1·K2,故答案为:-86.98;K1·K2;
②根据△G=△H-T△S<0时反应自发进行,反应I的△H<0,△S<0,则在低温下有利于该反应的进行,故答案为:低温;
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I:2NH3(g)+CO2(g)![]() NH2COONH4(s)。A.只有反应物中含有气体,氨气和二氧化碳的物质的量不变,混合气体的平均相对分子质量始终变化,不能说明达到了平衡状态,错误;B.容器内气体总压强不再变化,说明容器中气体的物质的量不变,说明达到了平衡状态,正确;C.根据方程式,V正(NH3)=2V逆(CO2)表示正逆反应速率相等,因此2V正(NH3)=V逆(CO2),表示的正逆反应速率不等,不能说明达到了平衡状态,错误;D.容器内混合气体的密度不再变化,说明混合气体的质量不变,说明达到了平衡状态,正确;故选AC;
NH2COONH4(s)。A.只有反应物中含有气体,氨气和二氧化碳的物质的量不变,混合气体的平均相对分子质量始终变化,不能说明达到了平衡状态,错误;B.容器内气体总压强不再变化,说明容器中气体的物质的量不变,说明达到了平衡状态,正确;C.根据方程式,V正(NH3)=2V逆(CO2)表示正逆反应速率相等,因此2V正(NH3)=V逆(CO2),表示的正逆反应速率不等,不能说明达到了平衡状态,错误;D.容器内混合气体的密度不再变化,说明混合气体的质量不变,说明达到了平衡状态,正确;故选AC;
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应不能建立平衡状态,氨气和二氧化碳的浓度始终为0,分解反应会一直进行下去,直至反应完全,故答案为:否;
(2)①T℃时,在容器中若充入稀有气体,容器的体积增大,相当于减小压强,平衡正向移动,则v(正)>v(逆);由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,T℃时,若充入等体积的CO2和CO平衡不移动,故答案为:>;不;
②由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有 C(s)+CO2(g)2CO(g)
开始(mol) 1 0
转化(mol) x 2x
平衡(mol) 1-x 2x
所以![]() ×100%=40%,解得x=0.25mol,则CO2的转化率为
×100%=40%,解得x=0.25mol,则CO2的转化率为![]() ×100%=25%,故答案为:25%;
×100%=25%,故答案为:25%;
③925℃时,CO的体积分数为96%,则CO2的体积分数都为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=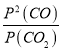 =
=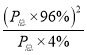 =23.04P总,故答案为:23.04P总。
=23.04P总,故答案为:23.04P总。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离于方程式正确的是
A. 向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B. 浓盐酸与MnO2反应制取Cl2:MnO2+4HCl(浓) ![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
C. 酸性条件下,碘化钾溶液露置于空气中变质:4H++4I-+O2=2I2+2H2O
D. 向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑灰的主要成分是硫化钡(BaS),常用于制取氧化钡等钡盐。
I.工业上常用如下方案测定黑灰中BaS含量:
步骤:准确称取一定质量黑灰试样置于烧杯中,加入适量的蒸馏水使黑灰充分溶解。
步骤2:过滤并洗涤残留固体2~3次,将滤液、洗涤液合并后完全转移至500mL容量瓶中,加水定容。
步骤3:取20.00mL步骤2中溶液于锥形瓶中,再迅速加入10mL2%醋酸稀溶液及25.00mL 0.5mo1/L碘标准溶液(过量),充分振荡,使BaS完全转化为S。
步骤4向锥形瓶中加入2-3滴淀粉溶液,用0.1mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积VmL(I2+2S2O32-=2I-+S4O62-)。
步骤5....
步骤6数据处理,计算黑灰中BaS含量。
(1)步骤2实验中所需的玻璃仪器有烧杯、漏斗.500mL容量瓶、_______。
(2)步骤4到达滴定终点时,滴定管中液面如图所示,此时滴定管读数为____mL。若盛装Na2S2O3标准溶液的滴定管未润洗,则所测得的BaS含量将会_______(填“偏高”、“偏低"或“不变”)。

(3)为保证实验结果的准确性,步骤5应为_______________。
II.氯化钡可用于测定煤矿酸性矿井水中硫酸盐的含量。
(1)酸性矿井水(主要含有H+、Fe2+、SO42-)是煤层中夹杂的硫铁矿(FeS2)被空气中氧气氧化所致,该反应的离子方程式为_______________。
(2)查阅资料发现铁元素的存在对SO2含量(mg/L)的测定结果影响较大。请补充完整测定酸性矿井水中SO42-含量的实验步骤:量取一定体积的酸性矿井水,________,根据采集的数据计算废水中SO42-含量。
(实验中须使用的试剂有:稀氨水、30%双氧水、1mol/LBaCl2溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为![]() ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )
①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚
A. ①②③⑥ B. ①②④⑤ C. ①②⑤⑥ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂以丙烯、乙烯为原料进行化工生产的主要流程如下。下列有关说法错误的是( )
![]() ,其中
,其中![]()
A.反应①与反应④均是取代反应
B.反应②与反应③均是加成反应
C.反应②中产物的结构简式为CH2BrCH2CHClBr
D.反应③、④表明硫酸是乙烯与水反应的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A.酯化反应也属于加成反应
B.酯化反应中羧酸脱去羧基中的羟基,醇脱去羟基中的氢原子生成水
C.浓硫酸在酯化反应中只起催化剂的作用
D.欲使酯化反应生成的酯分离并提纯,可以将酯蒸气通过导管伸入饱和碳酸钠溶液的液面下,再用分液漏斗分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水生产氯气、烧碱和氢气。
(1)该反应的化学方程式是:_______ 。
(2)电解食盐水的过程中,其中氧化剂为______,还原剂为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为:2Li + nS=Li2Sn,有关该电池说法正确的是( )
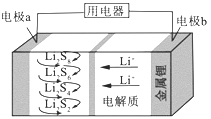
A. 放电时,Li+ 向负极迁移
B. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
C. 当外电路有2mol电子通过时,有1mol Li+通过阳离子交换膜
D. 该电池可以选用盐酸作为电解质增强溶液导电性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com