
| A. | B和C可能都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B是固体和C是气体 |
分析 正反应吸热,随着温度的升高,则平衡向正反应方向移动,气体平均相对分子质量变小,如气体的质量不变,则说明气体的物质的量增多,如气体的质量减小,则气体的物质的量不变也符合,以此解答该题.
解答 解:A.如B、C都是固体,则气体的平均相对分子质量不变,因为气体只有A,故A错误;
B.如B为气体,C为固体或液体,则升高温度平衡向正反应方向移动,气体的总质量减小,但物质的量不变,则气体平均相对分子质量变小,故B错误;
C.若C为固体,则B一定是气体,否则气体的平均相对分子质量不变,故C正确;
D.如B是固体和C为气体,平衡向正反应方向移动,气体的质量减小,气体的物质的量减小,则气体平均相对分子质量不一定减小,故D错误;
故选C.
点评 本题考查化学平衡移动,题目难度中等,注意判断气体的平均相对分子质量减小的两种情况.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.Fe2O3+3CO=2Fe+3CO2ΔH=-24.8 kJ•mol-1(反应热)
B.CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ•mol-1(反应热)
C.C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(g) ΔH=-2 658.0 kJ•mol-1(燃烧热)
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3 kJ•mol-1(中和热)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠加入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| B. | 铁粉加入到FeCl3溶液中:Fe+2Fe3+═3Fe2+ | |
| C. | 金属铝加入到NaOH溶液中:Al+2OH-+H2O═AlO2-+2H2↑ | |
| D. | 铜片插入到AgNO3溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LH2O所含分子数为0.5NA | |
| B. | 1mol•L-1CaCl2溶液中所含Ca2+离子的数目为NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 0.1molZn与含0.1molHCl的盐酸溶液充分反应,转移电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
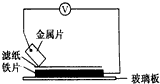 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D| A.在四种金属中C的还原性最弱 |
| B.金属B能从硫酸铜溶液中置换出铜 |
| C.AD若形成原电池时A为正极 |
| D.AB形成合金时,将该合金露置在空气中,A先被腐蚀 |
| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | +0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
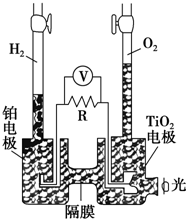 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )| A. | 该装置只能将光能转化为电能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O | B. | 硫酸 | C. | NaOH(s) | D. | Na2SO4(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com