
【题目】为了实现“将全球温度上升幅度控制在2℃以内”的目标,科学家正在研究温室气体CO2的转化和利用。
(1)海洋是地球上碳元素的最大“吸收池”
①溶于海水中的CO2主要以四种无机碳形式存在,分别为CO2、H2CO3、CO32-和_________(填离子符号)。
②在海洋中,可通过如图所示的途径来固碳。则发生光合作用时,CO2与H2O反应生成(CH2O)x和O2的化学方程式为__________________。

(2)有科学家提出可利用FeO来吸收CO2,已知:
C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
则6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) △H=_____kJ·mol-1。
2Fe3O4(s)+C(s) △H=_____kJ·mol-1。
(3)以CO2为原料可制备甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。

①若A点的正反应速率用v正(CO2)来表示,A点的逆反应速率用v逆(CO2)来表示,则v正(CO2)_______(填“>”“ <”或“=”)v逆(CO2)。
②0~3min内,氢气的平均反应速率v(H2)_______________。
(4)在一定条件下,二氧化碳转化为甲烷:CO2(g)+4H2(g)![]() CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K= ________。若200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K= ________。若200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
【答案】 HCO3- ![]() -76.0 > 0.75mol·L-1·min-1 25 <
-76.0 > 0.75mol·L-1·min-1 25 <
【解析】(1)①溶于海水中的CO2主要以四种无机碳形式存在,分别为CO2、H2CO3、CO32-和HCO3-;②发生光合作用时,CO2与H2O在叶绿素和酶的作用下反应生成(CH2O)x和O2,其反应的化学方程式为:![]() ;(2)已知:①C(s)+2H2O(g)
;(2)已知:①C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H1=+113.4 kJ·mol-1 ,
CO2(g)+2H2(g) △H1=+113.4 kJ·mol-1 ,
②3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g) △H2=+18.7 kJ·mol-1,根据盖斯定律,由②×2-①可得反应:6FeO(s)+CO2(g)
Fe3O4(s)+H2(g) △H2=+18.7 kJ·mol-1,根据盖斯定律,由②×2-①可得反应:6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) △H=2△H2-△H1=+18.7 kJ·mol-1×2-113.4 kJ·mol-1 = -76.0kJ·mol-1;(3) ①根据图中信息可知,CO2(g)的浓度还在降低,CH3OH(g)的浓度还在增大,反应还在向正方向进行且没达到平衡状态,则v正(CO2) >v逆(CO2);②0~3min内,CO2的平均反应速率v(CO2)=
2Fe3O4(s)+C(s) △H=2△H2-△H1=+18.7 kJ·mol-1×2-113.4 kJ·mol-1 = -76.0kJ·mol-1;(3) ①根据图中信息可知,CO2(g)的浓度还在降低,CH3OH(g)的浓度还在增大,反应还在向正方向进行且没达到平衡状态,则v正(CO2) >v逆(CO2);②0~3min内,CO2的平均反应速率v(CO2)=![]() ,化学反应速率之比等于计量数之比,则氢气的平均反应速率v(H2)=3 v(CO2)=
,化学反应速率之比等于计量数之比,则氢气的平均反应速率v(H2)=3 v(CO2)=![]() ×3=0.75mol·L-1·min-1;(4)c(CH4)=
×3=0.75mol·L-1·min-1;(4)c(CH4)=![]() c(H2O)=
c(H2O)=![]() ×1.6mol·L-1=0.8 mol·L-1,根据反应CO2(g)+4H2(g)
×1.6mol·L-1=0.8 mol·L-1,根据反应CO2(g)+4H2(g)![]() CH4(g)+2 H2O(g)可得300℃时,平衡常数K=
CH4(g)+2 H2O(g)可得300℃时,平衡常数K=![]() =
=![]() =25;若200℃时该反应的平衡常数K=64.8>25,则升高温度,平衡常数减小,则平衡向逆反应方向移动,逆反应方向为吸热反应,正反应方向为放热反应,△H<0。
=25;若200℃时该反应的平衡常数K=64.8>25,则升高温度,平衡常数减小,则平衡向逆反应方向移动,逆反应方向为吸热反应,正反应方向为放热反应,△H<0。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示。下列有关说法正确的是
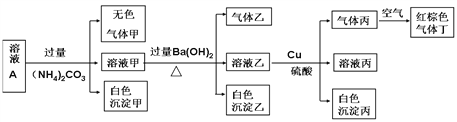
A. 实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
B. 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
C. 沉淀乙一定有BaCO3,可能有BaSO4
D. 一定没有Fe3+,但是无法确定是否含有I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的不断发展促进社会的进步。
(1)“天宫二号”内大量使用了碳纤维复合材料,在碳纤维复合材料中,碳纤维属于_____(填“增强剂”或“基体”);聚乙烯塑料常用于食品包装,聚乙烯塑料属于_________(填“热固性”或“热塑性”)塑料。硫化橡胶具有较高的强度和化学稳定性,它具有___________结构。天然橡胶的结构简式是________(填字母)。
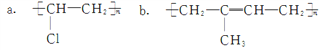 c. (C6H10O5)n
c. (C6H10O5)n
钢铁生锈的负极电极反应式为:_________________________。
(2)2015年某研究机构用一种新材料镍纳米粒子作催化剂,将二氧化碳和氢气在加热条件下转化为甲烷,该反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)实验室制取乙炔___________________。
(2)2 -氯丙烷的消去反应___________________。
(3)用甲苯制TNT的反应___________________。
(4)l,2-二氯乙烷与NaOH溶液共热___________________。
(5)![]() 中含有的含氧官能团名称________。
中含有的含氧官能团名称________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置
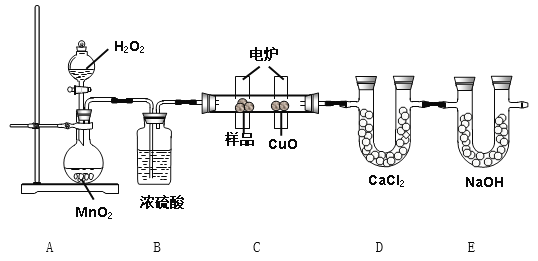
(1)A装置中MnO2的作用是________________;
(2)B装置中浓硫酸的作用是________________;
(3)燃烧管中CuO的作用是___________________;
(4)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取1.38 g样品,经充分反应后,D管质量增加1.62g,E管质量增加2.64g,则该样品的实验式(最简式)为_____________;
(5)要确定该物质的分子式,还要知道该物质的相对分子质量, 经测定其蒸气密度为2.054 g·L-1(已换算为标准状况下),则其分子式为________________;
(6)该物质的核磁共振氢谱如图所示,则其结构简式为__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。
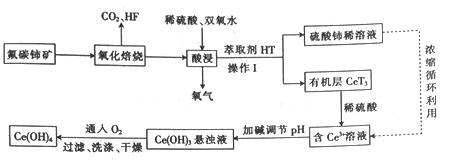
回答下列问题:
(1)CeFCO3中Ce的化合价为___________。
(2)氧化培烧时不能使用陶瓷容器,原因是_________________。氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为____________________。操作Ⅰ的名称为_________。
(3)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) ![]() CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:____________________。
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:____________________。
(5)298K时,向c(Ce3+)=0.02mol·L-1的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Ce3+是否沉淀完全?__________________{列式计算,已知:Ksp[Ce(OH)3]5×l0-20,c(Ce3+)-5mol·L-1 视为沉淀完全}。
(6)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①某NaCl样品中可能含有SO42﹣ , CO32﹣ , 为检验杂质离子的存在,采取如下实验步骤:
样品 ![]()
![]() 无明显现象
无明显现象 ![]() 无明显现象.则加入的试剂A为 , B为(填化学式),该现象证明样品中不含有 .
无明显现象.则加入的试剂A为 , B为(填化学式),该现象证明样品中不含有 .
②在后续实验中需要使用450mL0.5molL﹣1NaCl溶液,为配制该浓度NaCl溶液进行实验,需用托盘天平称取NaClg.
③配制NaCl溶液时,若出现下列操作,会使配制浓度偏高的是
A.称量时NaCl已潮解
B.天平砝码已锈蚀
C.定容时俯视刻度线
D.定容摇匀后液面下降,又加水至刻度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com