
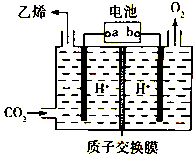
 CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )
CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )| A. | a为电池的正极 | |
| B. | 电解过程中H+移向阳极 | |
| C. | 反应前后溶液的pH保持不变 | |
| D. | 阴极反应式:2CO2+12H++12e-=C2H4+4H2O |
分析 电解强酸性的二氧化碳水溶液得到乙烯,二氧化碳得电子生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,为阴极反应,则a为电池的负极,b为电池的正极,阳极氢氧根失电子放出氧气,据此分析.
解答 解:A.由二氧化碳得电子生成乙烯,则为阴极反应,所以a为电池的负极,故A错误;
B.由离子的定向移动可知电解过程中H+移向阴极,故B错误;
C.阴极二氧化碳得电子生成乙烯,阳极氢氧根失电子放出氧气,总反应为:2CO2+2H2O=C2H4+3O2,消耗水,则pH减小,故C错误;
D.由二氧化碳得电子生成乙烯,则为阴极反应,电极反应式为2CO2+12H++12e-=C2H4+4H2O,故D正确.
故选D.
点评 本题考查电解池知识,为高考常见题型和高频考点,注意把握电解池的工作原理,本题解答的关键是根据二氧化碳得电子生成乙烯为阴极反应,以此可确定电源的两极和反应类型,注意体会答题思路,难度中等.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
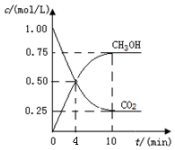 二氧化碳催化加氢合成甲醇的反应:
二氧化碳催化加氢合成甲醇的反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 烧碱的分子式为NaOH | |
| B. | 中子数为15的硅原子:${\;}_{14}^{20}$Si | |
| C. | 乙醇的结构简式:C2H5OH | |
| D. | NH3•H2O的电离方程式:NH3•H2O?NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
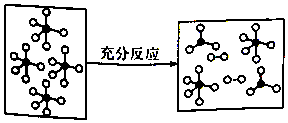 一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )| A. | 该反应可表示为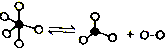 | |
| B. | 可能是PCl5的分解反应 | |
| C. | 反应过程中,一定伴随共价键的断裂与形成 | |
| D. | 该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 | |
| C. | 步骤Ⅱ中无色气体是NO气体 | |
| D. | 原溶液中肯定含有K+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H11Cl的有机物有8种同分异构体 | |
| B. | 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应 | |
| C. | 乙醇和乙酸都能与碳酸氢钠溶液反应 | |
| D. | 富含糖类和蛋白质的物质都易被人体消化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )| A. | 紫色石蕊溶液变红色,说明SO2呈酸性 | |
| B. | 品红溶液褪色,说明SO2具有漂白性 | |
| C. | 溴水橙色褪去,体现了SO2的还原性 | |
| D. | 含酚酞的NaOH溶液红色变浅,表明SO2能够和NaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com