
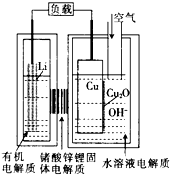
 正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 通空气时,铜被腐蚀,表面产生CuO | |
| B. | 放电一段时间后右侧水溶液电解质中LiOH浓度逐渐增大 | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂 |
分析 放电时,锂失电子作负极,Cu上O2得电子作正极,负极上电极反应式为Li-e-═Li+,正极上电极反应式为O2+4e-+2H2O=4OH-,电解质溶液中阳离子向正极移动,阴离子向负极移动,据此分析解答.
解答 解:A、该电池通过一种复杂的铜腐蚀而产生电力,由方程式可知铜电极上并非是氧气直接放电,正极反应为Cu2O+H2O+2e-=Cu+2OH-,因此通入空气的目的是让氧气与铜反应生成Cu2O,故A错误;
B、因为原电池放电时,阳离子移向正极,所以Li+透过固体电解质向Cu极移动,所以右侧水溶液电解质中LiOH浓度逐渐增大,故B正确;
C、该电池通过一种复杂的铜腐蚀而产生电力,由方程式可知铜电极上并非是氧气直接放电,正极反应为Cu2O+H2O+2e-=Cu+2OH-,故C正确;
D.铜先与氧气反应生成Cu2O,放电时Cu2O重新生成Cu,则整个反应过程中,铜相当于催化剂,故D正确;
故选A.
点评 本题考查了原电池原理,明确原电池负极上得失电子及电极反应式是解本题关键,题目难度中等,注意把握Cu在整个过程中的作用.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | NaHCO3 | NH4Cl | - | 加热 |
| C | Fe | Al | 氢氧化钠 | 洗气 |
| D | 乙烷 | 乙烯 | 溴水 | 蒸馏 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:S2->K+>F- | |
| B. | 沸点:HCl<HF | |
| C. | 反应速率:Fe加入稀H2SO4中<Fe加入稀H2SO4和含少量CuSO4的混合溶液中 | |
| D. | 给出质子的能力:CH3COOH>C2H5OH>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 环保太阳能公厕已在多地投入使用,其顶部的太阳能电池板可将太阳能转变成电能和热能 | |
| B. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 | |
| C. | 汽车尾气中的氮氧化物和碳氢化合物在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物-光化学烟雾也会引起雾霾,汽车尾气中含有氮氧化物,原因是汽油燃烧不充分 | |
| D. | 生物炼铜法就是利用某种能耐受铜盐毒性的细菌,利用空气中的氧气把不溶性的硫化铜转化为可溶性的铜盐,从而使铜的冶炼变得成本低,污染小,反应条件十分简单 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3 | B. | Na2SO4 | C. | Ca(OH)2 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 第一组 | A-268.8 | B-249.5 | C-185.8 | D-151.7 |
| 第二组 | F2-187.0 | Cl2-33.6 | Br2 58.7 | I2 184.0 |
| 第三组 | HF 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | H2Se-42.0 | H2Te-1.8 |
| A. | 第四组物质中H2O的沸点最高,是因为H2O分子之间存在氢键 | |
| B. | 第三组与第四组相比较,化合物的稳定性顺序为:HBr>H2Se | |
| C. | 第二组物质,单质的氧化性:F2>Cl2>Br2>I2 | |
| D. | 第一组物质是分子晶体,一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | B. | 用托盘天平称取5.20 g氯化钠 | ||
| C. | 用100 mL量筒量取5.2mL盐酸 | D. | 用蒸馏可以除去水中的Fe3+等杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com