
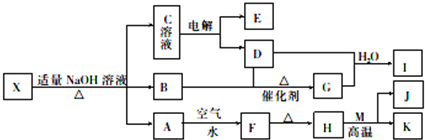
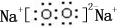 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
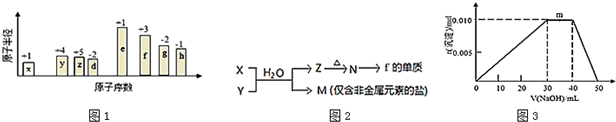
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)分析 从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素;
(1)f是Al元素;
(2)非金属性越强,最高价氧化物水化物的酸性越强;
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,则A为Na2O2,B是常见的液态化合物,其稀溶液易被催化分解,则B为H2O2;
(4)①由 反应转化可知,f为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应;
反应转化可知,f为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应;
②M溶液中铵根离子水解呈酸性,要使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,根据溶液的电中性分析;
(5)①m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O;
②10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,结合反应计算.
解答 解:从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素;
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族,故答案为:第三周期ⅢA族;
(2)非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4>H2CO3,故答案为:HClO4;H2SO4;H2CO3;
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,则A为Na2O2,其电子式为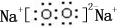 ,B是常见的液态化合物,其稀溶液易被催化分解,则B为H2O2,能使双氧水解的催化剂为MnO2、FeCl3,故选AB,
,B是常见的液态化合物,其稀溶液易被催化分解,则B为H2O2,能使双氧水解的催化剂为MnO2、FeCl3,故选AB,
故答案为: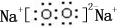 ;AB;
;AB;
(4)①由 反应转化可知,f为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
反应转化可知,f为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
②M溶液中铵根离子水解呈酸性,要使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,根据溶液的电中性可知c(H+)=c(OH-),所以应向溶液中加入一定量的Y溶液至溶液呈中性,
故答案为:溶液呈中性;
(5)①m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O,离子方程式为:NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O;
②10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
(0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
(0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022.
点评 本题考查无机物的推断,为高频考点,把握元素化合物的性质、化学反应的计算为解答的关键,侧重分析与推断能力的考查,注意元素化合物的性质,题目难度不大.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol C4H10分子中共价键总数为13NA | |
| B. | 1L 1mol•L-1 盐酸中,含有HCl分子数为NA | |
| C. | 18g D2O 中含有的质子数和电子数均为10NA | |
| D. | 1molCl2与Fe 反应转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Fe(OH)3(胶体)+3H+,生成的少量Fe(OH)3胶体可以吸附水中的悬浮杂质,达到净水的目的.
Fe(OH)3(胶体)+3H+,生成的少量Fe(OH)3胶体可以吸附水中的悬浮杂质,达到净水的目的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3moL•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
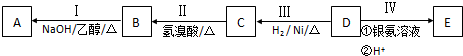
 ;
; ;
;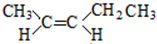 和
和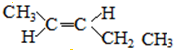 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
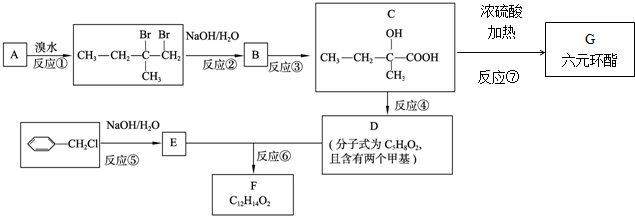
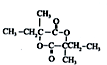 .
.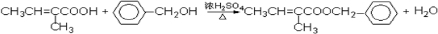 .
.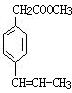 、
、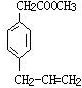 、
、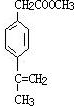 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①②④ | C. | ②③⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com