
| A. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| B. | 标准状况下,11.2 L由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
分析 A.氧气状况未知,Vm不确定;
B.依据n=$\frac{V}{Vm}$计算混合气体的物质的量,结合氮气、一氧化碳都是双原子分子解答;
C.气体摩尔体积使用对象为气体;
D.常温常压Vm≠22.4L/mol.
解答 解:A.氧气状况未知,Vm不确定,无法计算氧气的物质的量和分子数,故A错误;
B.氮气、一氧化碳都是双原子分子,标准状况下,11.2 L由N2与CO组成的混合气体物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,所以含有原子数目为0.5mol×2×NA=NA,故B正确;
C.标况下四氯化碳为液体,不能使用气体摩尔体积,故C错误;
D.常温常压Vm≠22.4L/mol,Vm未知,无法计算混合气体的物质的量和氧原子个数,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大,注意气体摩尔体积使用条件和对象.


科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的 pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至 10 倍后 pH=4 | |
| C. | pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH>7 | |
| D. | pH 均为3的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①⑥ | C. | ① | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中,可用金属钠检验乙醇中是否含有水 | |
| B. | 甲烷是天然气的主要成分,能发生取代反应,但不能发生氧化反应 | |
| C. | 只用水无法鉴别苯、乙酸和四氯化碳 | |
| D. | 植物油不能用于萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式 C2H4O2 | B. | 氯化钠的电子式: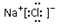 | ||
| C. | 硫原子的原子结构示意图: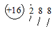 | D. | 水的电离方程式 2H2O═H3O++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶于水能形成氢氧化铝胶体,可用于自来水的杀菌消毒 | |
| B. | 氧化镁熔点高,可用于耐高温材料 | |
| C. | 碳酸钠具有碱性,可用于胃酸中和剂 | |
| D. | 铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向海水中加入净水剂明矾可以使海水淡化 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 海水淡化的方法主要有电渗析法、蒸馏法、离子交换法等 | |
| D. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 |
查看答案和解析>>
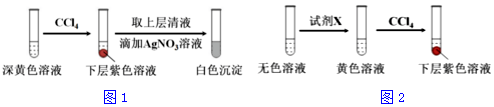
科目:高中化学 来源: 题型:解答题
| 实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
 | 1 | 0.05mL | 浅黄色 | 无色 |
| 2 | 0.20mL | 深黄色 | 无色 | |
| 3 | 0.25mL | 浅黄色 | 蓝色 | |
| 4 | 0.30mL | 无色 | 蓝色 |
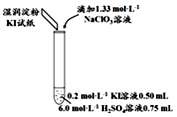
| 编号 | 6.0mol•L-1 H2SO4 溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25mL | 浅黄色 | 无色 |
| 6 | 0.85mL | 无色 | 蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com