
【题目】下列实验操作正确的是( )
A.用托盘天平称取1.06gNa2CO3固体
B.用10mL量筒量取8.58mL蒸馏水
C.用稀盐酸洗净做焰色反应的铁丝
D.为了加快过滤的速率,用玻璃搅拌过滤器中的溶液
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】在实验室可用如图所示装置制取少量乙酸乙酯。有关叙述不正确的是( )

A. 长导管起冷凝、导气的作用
B. 用蒸馏法从所得混合溶液中分离出乙酸乙酯
C. Na2CO3饱和溶液的作用之一是吸收未反应的乙酸
D. 导管末端不插入饱和Na2CO3溶液中是为了防倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
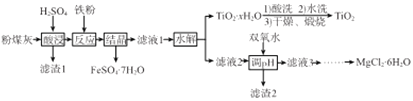
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]=1.0×10-11
请回答下列问题:
(1)“酸浸”时TiO2发生反应的离子方程式为_______________。
(2)“反应”时加入铁粉的作用为_______________。
(3)“结晶”需控制在70℃左右,温度过高会导致的后果为_____________。
(4)“水解”反应的离子方程式为______________。所得TiO2xH2O 沉淀进行酸洗的目的为____________。
(5)为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”最小为________。
(6)实验室用MgCl2溶液制备MgCl26H2O,需进行的操作为_____、降温结晶、过滤、洗涤、干燥。
(7)FeSO47H2O样品纯度的测定:取a g样品溶于水配成bmL.溶液;用酸化的cmol/LKMnO4标准溶液滴定,达到滴定终点时消耗标准液的体积为dmL,样品中FeSO47H2O的质量分数为____ (用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物M是合成香精的重要原料。实验室由A和芳香烃E制备M的一种合成路线如下:
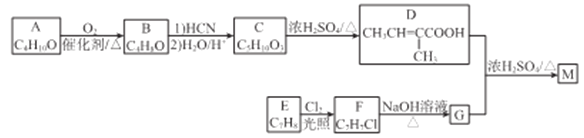
已知: (R1、R2表示烃基或H原子)
(R1、R2表示烃基或H原子)
请回答下列题:
(1)A的化学名称为_________,B的结构简式为________。
(2)C中官能团的名称为________。
(3)D分子中最多有___个原子共平面。
(4)E→F的反应类型为________。
(5)D+G→M的化学方程式为________。
(6)同时满足下列条件的D的同分异构体有___种(不考虑立体异构),其中核磁共振氢谱有3组峰的结构简式为________。
①能发生水解反应和银镜反应; ②不含环状结构
(7)参照上述合成路线和信息。以![]() 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线_______________________。
的合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)己知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),△H=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g), △H=-566.0kJ/mol
③H2O(g)=H2O(l), △H=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式__________________。
(2)某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置。
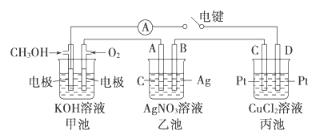
①甲池负极的电极反应为__________________。
②工作一段时间后,测得甲中溶液的pH减小,该电池总反应的离子方程式为______。
③乙池中A(石墨)电极的名称为__________________(填“正极”、“负极”或“阴极”、“阳极”),乙池中总反应式为_________。
④当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为__mL(标准状况),假设乙池、丙池中的溶液均为足量,丙池中____(填“C”或“D”)极析出______g铜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
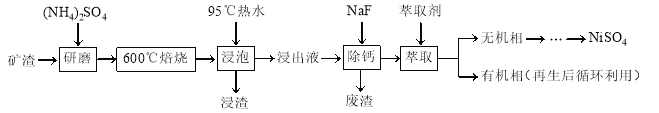
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为______________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为______________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
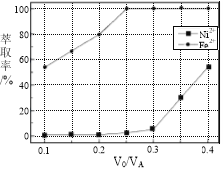
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯的结构简式是CH2CH2
B.乙酸和乙醇都既能与钠反应产生气体,又能与碳酸钠反应产生气体
C.C4H10的一氯取代物共有4种
D.标准状况下,22.4L氯仿中含有3molCl原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______________;(填序号),配制上述溶液还需用到的玻璃仪器是______________(填仪器名称);

(2)配制NaOH时,在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”、“等于”或“小于”).
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_____________mL(计算结果保留一位小数).在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所得配得溶液浓度_____________0.5mol/L(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示是由3个圆所构成的类别关系图,其中I为大圆,II和III分别为大圆之内的小圆。下列选项中符合这种类别关系的是( )

A. I: DNA II: RNA III:核酸
B. I:还原性糖 II:果糖 III:蔗糖
C. I:固醇 II:胆固醇 III:维生素D
D. I:蛋白质 II:酶 III:激素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com