
分析 (1)由于题中强调足量的草酸,故反应后草酸转化为HC2O4-,若写成C2O42-是错误的.
(2)中显然说明草酸具有还原性,把MnO4-还原为Mn2+,根据氧化还原反应得失电子守恒配平反应方程式;
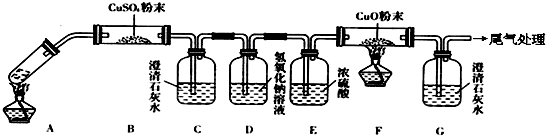
(3)乙二酸分解的化学方程式为H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成;
(4)两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度;
(5)根据NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于其水解程度,可得离子浓度间的大小关系.
解答 解:(1)题中强调足量的草酸,故反应后草酸转化为HC2O4-,且酸性强于碳酸,反应的离子方程式为HCO3-+H2C2O4=HC2O4-+CO2↑+H2O,故答案为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明具有氧化性的高锰酸钾被还原,说明草酸具有还原性,把MnO4-还原为Mn2+,反应中根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,在根据电荷守恒和质量守恒可写出反应方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:还原性;2;5;6;2;10;8;
(3)①乙二酸分解的化学方程式为H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成,
故答案为:H2O、CO、CO2;H2C2O2$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑;
(4)两者正好1:1反应生成NaHC2O4,溶液显酸性,说明HC2O4-的电离程度大于其水解程度,
故答案为:反应生成NaHC2O4,HC2O4-的电离程度大于其水解程度;
(5)两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度,而溶液中还存在着水的电离,故H+>C2O42-,由于离子的电离程度较小,则有HC2O4->H+,故正确顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
点评 本题考查已二酸的分解以及溶液离子浓度的大小比较,难度不大,题目较为综合且具有一定难度,做题时注意抓住反应的现象,以此推断物质可能具有的性质.


科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A. | 前10 min内反应的平均速率为 v(C)=0.050 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)>0.25 mol | |
| C. | 若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动 | |
| D. | 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 铁锅生锈的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KOH溶液与AlCl3溶液 | B. | AlCl3溶液与氨水 | ||
| C. | NaAlO2溶液与盐酸 | D. | NaHCO3溶液与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4、HClO、BaCO3是电解质 | |
| B. | 生石灰与水混合发生化学、物理变化 | |
| C. | 丁达尔效应可以区分溶液与胶体 | |
| D. | 光导纤维中所用材料为晶体硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com