
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X元素形成的单核阴离子还原性强于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
分析 W、X、Y、Z四种短周期元素,W的气态氢化物可使湿润的红色石蕊试纸变蓝,则W是N元素,由元素在周期表中的物质可知,X为O元素、Y为S元素、Z为Cl元素,然后结合元素周期律来解答.
解答 解:W、X、Y、Z四种短周期元素,W的气态氢化物可使湿润的红色石蕊试纸变蓝,则W是N元素,由元素在周期表中的物质可知,X为氧元素、Y为硫元素、Z为氯元素.
A.非金属O>S,Cl>S,则其氢化物中H2S最不稳定,故A正确;
B.只有氯元素的最高价含氧酸才一定比Y的含氧酸酸性强,故B错误;
C.非金属性O>S,故X元素形成的单核阴离子还原性弱于Y,故C错误;
D.Cl2与水的反应生成HCl、HClO,Cl失去电子也得到电子,既表现氧化性,也表现了还原性,故D错误;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” | |
| B. | 核外电子数为偶数的基态原子,其原子轨道中可能不含“未成对电子” | |
| C. | 核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子” | |
| D. | 核外电子数为奇数的基态原子,其原子轨道中一定不含“未成对电子” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a${\;}^{-\frac{1}{2}}$ | B. | a${\;}^{\frac{1}{2}}$ | C. | a2 | D. | aˉ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 纯净物与混合物属于包含关系 | |
| B. | 化合物与单质属于包含关系 | |
| C. | 金属氧化物与酸性氧化物属于交叉关系 | |
| D. | 电解质与非金属氧化物属于并列关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
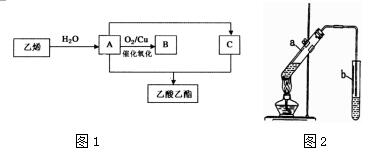
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com