
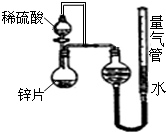
 某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.
某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.| 序号 | Ⅴ(H2SO4)/mL | C(H2SO4)/mol?L-1 | t/s |
| Ⅰ | 10 | 1 | t1 |
| Ⅱ | 10 | 3 | t2 |


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
| C(H+) |
| C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
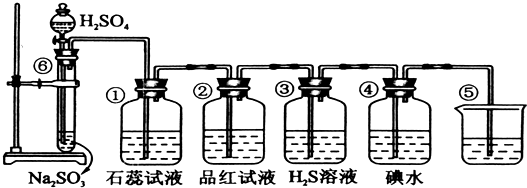
查看答案和解析>>
科目:高中化学 来源: 题型:

| Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | |
| Ksp | 8.0×10-16 | 2.2×10-22 | 4.0×10-38 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
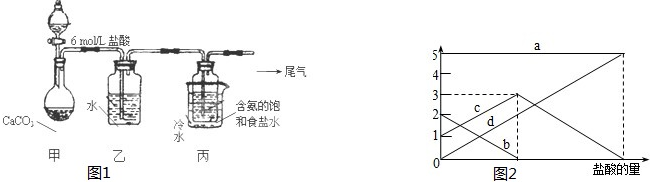
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、混合溶液中c(K+)>c(NO
| ||
B、混合溶液中c(K+)>c(NO
| ||
| C、加入AgNO3溶液时首先生成AgCl沉淀 | ||
D、混合溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1 mol?L-1 HF溶液中pH=1 |
| B、Ksp(CaF2)随温度和固体质量的变化而变化 |
| C、该体系中没有沉淀产生 |
| D、在原HF和NaF混合液中,2c(Na+)=c(F-)+c(HF) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com