
| A. | Cu2+、NH4+、SO42-、Cl-、 | B. | Na+、K+、CO32-、Cl- | ||
| C. | K+、Fe2+、MnO4-、Cl- | D. | Na+、K+、NO3-、Cl- |
科目:高中化学 来源: 题型:选择题
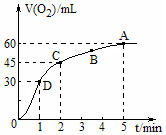 在50mL过氧化氢溶液中加入1g MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示,下列说法不正确的是( )
在50mL过氧化氢溶液中加入1g MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示,下列说法不正确的是( )| A. | 标准状况下,实验放出一半气体所需的时间为1min | |
| B. | A、B、C、D各点反应速率中A点最慢,D点快 | |
| C. | 0~2min内产生O2的平均反应速率为22.5mL•min-1 | |
| D. | 本实验中影响反应速率的因素只有催化剂和H2O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑤⑦ | C. | ④⑧ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V一定等于0.2 | |
| B. | V大于或等于0.2 | |
| C. | 混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 混合溶液中离子浓度一定满足:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
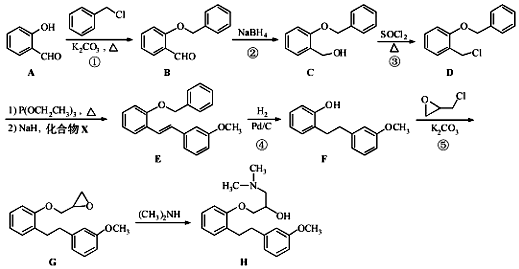
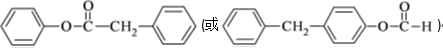 .
.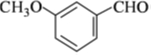
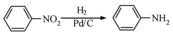 .化合物
.化合物 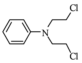 是合成抗癌药物美法伦的中间体,请写出以
是合成抗癌药物美法伦的中间体,请写出以 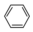 和
和  为原料制备该化合物的合成路线流程图(无机试剂任用).
为原料制备该化合物的合成路线流程图(无机试剂任用).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com