
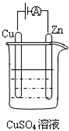
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)| 96g |
| 64g/mol |


科目:高中化学 来源: 题型:
| A、等压时,通入惰性气体,c的物质的量不变 |
| B、等压时,通入z气体,反应器中温度下降 |
| C、等容时,通入惰性气体,各反应速率不变 |
| D、等容时,通入z气体,z的物质的量浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
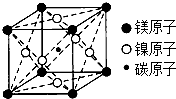 材料是人类赖以生存的重要物质基础.铜、镍等金属材料在现代社会中有着重要应用.请回答下列问题:
材料是人类赖以生存的重要物质基础.铜、镍等金属材料在现代社会中有着重要应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于 | B、等于 |
| C、小于 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰乳中Ca(OH)2的电离:Ca(OH)2(s)?Ca2++2OH- | ||||
| B、向AgC1悬浊液中滴加Na2S溶液产生黑色沉淀:2AgC1(s)+S2-=Ag2S(s)+2C1- | ||||
| C、向NaHCO3溶液中加入过量的石灰水产生白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O | ||||
D、Fe(OH)3胶体的制备:FeCl3+3H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com