
 (1)下面所列的是中学化学实验中几种常见的仪器:
(1)下面所列的是中学化学实验中几种常见的仪器:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| 26.11+26.09 |
| 2 |
| 0.0261L×0.1000mol/L |
| 0.025L |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
| A、酸性由强至弱:HX>HY>H2CO3 |
| B、结合H+的能力:Y->CO32->X->HCO3- |
| C、溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D、NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
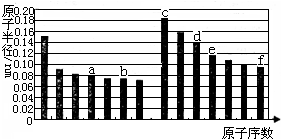
| A、a的单质在高温条件下能置换出e的单质,说明非金属性a<e |
| B、b、d两种元素的离子半径相比,前者较大 |
| C、由b、e两种元素组成的化合物能溶解于强碱溶液,但不能与酸溶液反应 |
| D、由c、d分别与f组成的化合物中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A、T1温度下,500s时O2的浓度为0.74mol?L-1 | ||
B、平衡后其它条件不变,将容器的体积压缩到原来的
| ||
| C、T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | ||
| D、T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com