
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:


查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如右图是所示。
(1)右图中的线2表示的组分为 (填化学式)。
(2)实验时,“反应II”中加入NaOH溶液的目的是 (用化学方程式表示)。
(3)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了两种方法进行测定。
①方法I:称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)
②方法II:称取1.326g产品,配成100mL溶液,取25.00mL该溶液,滴加0.1250mol/L I2溶液,恰好使Na2SO3完全氧化生成Na2SO4时,消耗I2溶液20.00mL。通过计算确定产品中Na2SO3的质量分数(写出计算过程)
③判断Na2SO3产品的等级,并说明理由。
【答案】(1)线2表示的组分为NaHCO3。(2)NaHSO3+NaOH=Na2SO3+ H2O(主要)
SO2+2NaOH=Na2SO3+H2O(次要)
(3)①98.05% ②95.02%③产品为一等品。产品中含有的硫酸钠和碳酸钠,在方案I的测定中,硫酸钠和碳酸钠杂质使得测定值偏高。而方案II是直接测定亚硫酸钠,更可信。
【解析】
试题分析:(1)结合图像可知在Na2CO3溶液里通入SO2,依次发生反应的化学方程式为2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3,2NaHCO3+SO2=Na2SO3+2CO2↑,Na2SO3+SO2+H2O=2NaHSO3;据此可知线2表示的组分为NaHCO3;
(2)I中得到的是NaHSO3溶液, 则II中加入NaOH溶液的目的是中和NaHSO3得到Na2SO3,发生反应的化学方程式为NaHSO3+NaOH=Na2SO3+ H2O(主要)、SO2+2NaOH=Na2SO3+H2O(次要);
(3)方法I:Na2SO3+H2O2=Na2SO4+H2O,Na2SO4+ BaCl2=2NaCl+BaSO4↓
m(BaSO4)=4.660,n(BaSO4)=4.660g÷233g/mol=0.020mol,则经氧化后n(Na2SO4)=0.020mol,m(Na2SO4)=0.020mol×142g/mol=2.840g,根据差量法,原混合物中的Na2SO3:n(Na2SO3)=![]() ,m(Na2SO3)=
,m(Na2SO3)=![]() ×126 g/mol=2.12625g,w(Na2SO3)=
×126 g/mol=2.12625g,w(Na2SO3)=![]() ×100%≈82.73%。如若不考虑杂质,则n(Na2SO3)=n(BaSO4)=0.020mol,m(Na2SO3)=0.020mol×126 g/mol=2.520g,w(Na2SO3)=
×100%≈82.73%。如若不考虑杂质,则n(Na2SO3)=n(BaSO4)=0.020mol,m(Na2SO3)=0.020mol×126 g/mol=2.520g,w(Na2SO3)=![]() ×100%≈98.05%。
×100%≈98.05%。
方法II:Na2SO3+I2+ H2O=Na2SO4+ 2HI
n(Na2SO3)=n(I2)=20.00mL×10-3L/mL×0.1250mol/L=0.0025mol,m(Na2SO3)=0.0025mol×126 g/mol×![]() =1.260g,w(Na2SO3)=
=1.260g,w(Na2SO3)=![]() ×100%≈95.02%。
×100%≈95.02%。
方案I中的产品为优等品,方案II中的产品为一等品。但是方案I产品中含有的硫酸钠和碳酸钠等杂质,在方案I的测定中,硫酸钠和碳酸钠杂质对测定有干扰,而方案II是直接测定亚硫酸钠,可信度和精确度都要更高一些。


科目:高中化学 来源: 题型:
【题目】 A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)A在周期表中的位置是 。AFD的电子式为 。
(2) BD2的结构式为 ; BD2形成晶体的类型为 。
(3)元素D、E 、F形成的简单离子的半径由大到小为 (用离子符号表示)。
(4)写出实验室制备单质F的离子方程式 。
(5)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是人类文明发展的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)工业生产粗硅的反应有:SiO2+2C![]() Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C![]() SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
(2)工业上可以通过如下图所示的流程制取纯硅:
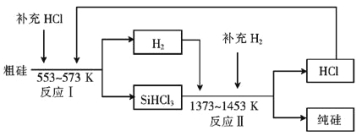
①若反应I为 Si(粗)+3HCl![]() SiHCl3+H2,则反应II的化学方程式为 。
SiHCl3+H2,则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。

(1)元素R在周期表中的位置是 。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为 。
(3)测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为 。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
A.相同条件下水溶液的PH:Na2CO3>Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为: 。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则A的化学式为 ;若气体a为单质,反应 II的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g) ![]() 2NO(g) △H1=+180.5 kJ·mol-1
2NO(g) △H1=+180.5 kJ·mol-1
② C和CO的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
则2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)的△H=_____kJ·mol-1
N2(g) + 2CO2(g)的△H=_____kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
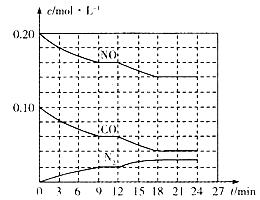
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1(保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数值为________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收,若将一定量的SO2气体通入到300mL NaOH的溶液中,再在所得溶液中逐滴加入稀盐酸至过量,产生的气体与反应的HCl两者物质的量的关系如图所示(气体的溶解和HCl的挥发忽略,NaHSO3水溶液为酸性):
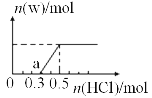
①O点溶液中所含溶质的化学式为_________________;
②a点溶液中各离子溶度大小关系为______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是
A.X离子的氧化性比Y离子氧化性强
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于氨水
D. W单质的氧化性比Z单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A.反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2仅体现氧化性的反应是(填序号,下同)_________,H2O2既体现氧化性又体现还原性的反应是________。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是_____________
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①写出上述反应的离子方程式并配平
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为_______mol。
(4) H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+H2O2+H2O===A+NH3↑,试指出生成物A的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室用浓硫酸、溴化钠(先生成HBr)与乙醇反应来制备溴乙烷(C2H5Br)的装置,反应需要加热,图中省去了夹持与加热装置,有关物质的性质如下表。


(1)分别写出A、B两种仪器的名称 、 。
(2)冷却剂应从 (填“h”或“i”)口进入冷凝管C中,制备操作中,加入的浓硫酸必须进行适当稀释,其目的(或原因)是 (填字母)。
a.水是反应的催化剂 b.减少Br2的生成 c.减少HBr的挥发
(3)加热的目的是 ,使用D进行冷却的原因是 。
(4)A中液面上有深红棕色气体出现,写出生成它的化学方程式 ,写出A中生成溴乙烷的化学方程式 。
(5)将E中产品转入到分液漏斗中,再向漏斗中加入适量Na2SO3溶液,振荡静置后分液。加入Na2SO3溶液的目的是 ,分液时目标产物离开漏斗的方式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com