
| m |
| M |
| N |
| NA |
| m |
| M |
| 6g |
| 2g/mol |
| 1.204×1024 |
| 6.02×1023mol-1 |
| 147g |
| 98g/mol |
| 92g |
| 46g/mol |
| 9g |
| 18g/mol |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
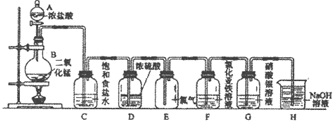
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| b |
| 1 |
| 2 |
| a |
| b |
| a |
| b |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 防治禽流感病毒目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如下图所示,下列关于莽草酸的说法正确的是( )
防治禽流感病毒目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如下图所示,下列关于莽草酸的说法正确的是( )| A、莽草酸的分子之间可能发生酯化反应 |
| B、莽草酸的分子式为C7H4O5 |
| C、莽草酸中含有苯环 |
| D、莽草酸能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硒化氢(H2Se)是无色、有毒,比H2S稳定的气体 |
| B、氢氧化铍[Be(OH)2]的碱性比氢氧化镁弱 |
| C、单质砹(At)为有色固体,AgAt不溶于水也不溶于稀酸 |
| D、硫酸锶(SrSO4)是难溶于水的白色固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com