
A.石蕊和水 B.酚酞试液和水
C.NaOH溶液 D.pH试纸和水
科目:高中化学 来源: 题型:阅读理解
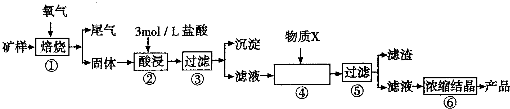
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下: 甲:①准确配制0.1mol·L-1的HA、HCl溶液各100 mL;
②取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA 、HCl溶液各10 mL,按图装好,观察现象
乙:①用pH计测定物质的量浓度均为0.1 mol·L-1 HA和HCl溶液的pH;
②再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/20 mL)分别稀释至100mL,再用pH计测其pH变化
(1) 甲、乙两方案中都要用到__________ mL的容量瓶。乙方案中说明HA是弱电解质的理由是,测得0.1 mol·L-1的HA溶液的pH 1(填“>”、“<”或“=”) ;甲方案中,说明HA是弱电解质的实验现象是:
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后, 试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第______步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol/L的HA溶液中,选择加入_________试剂;②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol/L的HA溶液中,选择加入________试剂。
A. NaA固体(可完全溶于水) B.1 mol/LNaOH溶液
C. 1 mol/L H2SO4 D.2 mol/LHA
(3)pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示。
则下列说法不正确的有( )。
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7)。
Ⅰ.测定溶液的pH值所用的主要仪器有:pH试纸、表面皿、 和标准比色卡。
Ⅱ.有关①100mL0.1mol·L-1NaHCO3、②100mL0.1 mol·L-1Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的OH-个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO32-)>c(H2CO3) D.②溶液中:c(HCO3-)>c(H2CO3)
(2)乙同学取一定量的碳酸钠溶液于试管中,滴加2~3滴酚酞试液,发现溶液变红,继续滴加BaCl2溶液,预计可观察到 ,请你结合必要的离子方程式,应用平衡的观点解释有关现象的产生: 。
(3)常温下,现有pH均为11的标签模糊的NaOH和Na2CO3溶液,则NaOH溶液中由水电离出来的OH-浓度为Na2CO3溶液中水电离出来OH-浓度的 倍。丙同学设计如下实验予以区别:各取1mL两种溶液加水稀释至1L,分别测定其pH。请问丙同学是如何判断哪瓶溶液为Na2CO3溶液? ;丁同学各取1mL两种溶液,分别滴加少量AlCl3溶液观察有无沉淀或气体进行鉴别,则溶液滴加后同时产生沉淀和气体的反应离子方程式为 。
(4)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.400 mol·L-1的Na2CO3溶液和0.200 mol·L-1的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)
I.常温下浓度均为0.l mol/L的下列溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水
回答下列问题。
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 。
(2)四种溶液中对水的电离抑制作用最大的是 ;比较①、②溶液,pH较大的是 。
(3)在溶液④中加入NH4Cl固体,NH+4浓度与OH-浓度的比值将____(填“变大”、“变小”、“不变”)
II.有一瓶无色澄清溶渡,其中可能含有:NH+4、K+、Mg2+、Al3+、Fe2+、NO-3、Cl-、SO2-4、CO2-3取该溶液进行下列实验:
(1)取部分溶液,向其中逐滴滇入Ba(OH)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。
(2)取(I)反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少。将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份如HNO3酸化时有白色沉淀产生,继续加HNO3,沉淀又消失,再加AgNO3没有变化。
根据以上事实确定:该溶液中肯定存在的离子有 ;
肯定不存在的离子有____ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(四)化学试卷(A卷)(解析版) 题型:填空题
[2012·潍坊高三期末] (6分)(1)下面a~f是中学化学实验中常见的几种玻璃仪器:
a.烧杯 b.容量瓶 c.试管 d.量筒 e.滴定管 f.圆底烧瓶
①其中标出仪器使用温度的是________(填编号,下同);
②使用前要检查仪器是否漏液的是________;
③可作反应容器并可直接加热的是________。
(2)化学是一门以实验为基础的科学,化学实验是学习的重要内容。根据你掌握的知识,判断下列描述正确的是 (填序号)。
A.将一块pH试纸浸入稀盐酸中,测定溶液pH
B.用25mL酸式滴定管量取18.80mLKMnO4溶液
C.用苯萃取碘水中的I2时,有机层从分液漏斗的上口倒出
D.各放一张质量相同的滤纸于天平的两盘上,将NaOH固体放在左盘纸上称量
E.某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,则该钾盐为K2CO3
F.向某溶液中加入Ba(NO3)2溶液有白色沉淀产生,加盐酸沉淀不消失,则原溶液中一定含有SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com