
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
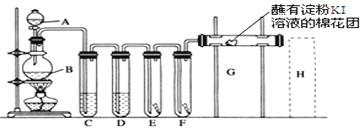
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式___________________。
(2)D中放入浓H2SO4其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论是________________________________。
(4)G处的现象是____________________________________。
(5)用化学方程式写出H处尾气吸收装置中的反应原理____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①消毒液与洁厕灵不能同时使用,原因是(用离子方程式表示)____________。
②需“密闭保存”的原因____________________________________________。
(7)工业上用亚氯酸钠和稀盐酸为原料制备 ClO2 ,写出反应的化学方程式____________。Cl2和ClO2都是强氧化剂,能杀死水中的病菌。等质量的ClO2的氧化能力是Cl2的_______倍。
(8)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,如:[(SCN)2+H2O = HSCN+HSCNO]。它们阴离子的还原性强弱为 Cl-<Br-<CN-<SCN-<I-。试写出:KBr和KSCN的混合溶液中加入(CN)2,反应的化学方程式为_________________。
【答案】MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 除去氯气中的水蒸气 E中不褪色,F中褪色 干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性 出现蓝色 Cl2+2NaOH=NaCl+NaClO+H2O Cl+ClO+2H+===Cl2↑+H2O 次氯酸钠与空气中的二氧化碳反应 5NaClO2+4HCl= 4ClO2↑+5NaCl+2H2O 2.63 CN2+2KSCN===2KCN+(SCN)2
Mn2++Cl2↑+2H2O 除去氯气中的水蒸气 E中不褪色,F中褪色 干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性 出现蓝色 Cl2+2NaOH=NaCl+NaClO+H2O Cl+ClO+2H+===Cl2↑+H2O 次氯酸钠与空气中的二氧化碳反应 5NaClO2+4HCl= 4ClO2↑+5NaCl+2H2O 2.63 CN2+2KSCN===2KCN+(SCN)2
【解析】
根据实验装置分析实验过程中涉及的化学反应及反应现象;根据物质的组成分析常见化学品的安全使用;根据氧化还原反应原理分析和书写化学方程式。
(1)浓盐酸与二氧化锰加热反应生成氯气,离子方程式为MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)根据实验装置图知,浓H2SO4其目的是除去氯气中的水蒸气,
故答案为:除去氯气中的水蒸气;
(3)E中为红色干布条,F中为红色湿布条,氯气和水反应生成次氯酸,而次氯酸具有强氧化性,有漂白作用,所以可观察到的现象是E中不褪色,F中褪色,对比E和F中现象的差异可得出的结论是干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性,
故答案为:E中不褪色,F中褪色;干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性;
(4)如图所示,生成的氯气与碘化钾溶液反应生成单质碘,淀粉遇碘变蓝,所以G处的现象是出现蓝色,
故答案为:出现蓝色;
(5)用氢氧化钠溶液吸收氯气,反应为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(6)①消毒液与洁厕灵不能同时使用,原因是发生了化学反应,离子方程式为:Cl+ClO+2H+===Cl2↑+H2O,
故答案为:Cl+ClO+2H+===Cl2↑+H2O;
②需“密闭保存”的原因是次氯酸钠与空气中的二氧化碳反应,
故答案为:次氯酸钠与空气中的二氧化碳反应;
(7)亚氯酸钠NaClO2中Cl元素化合价为+3价, NaClO2→ClO2,+3价的氯元素化合价升高到+4价,NaClO2→NaCl,+3价的氯元素的化合价降低到-1价,NaClO2在反应中既是氧化剂又是还原剂,根据电子守恒,得到方程式为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O; 氧化能力是得电子的能力,根据氯元素的化合价,等质量的ClO2和Cl2的得电子数之比为:![]() 5:
5:![]() ×2,即2.63,所以等质量的ClO2的氧化能力是Cl2的2.63倍,
×2,即2.63,所以等质量的ClO2的氧化能力是Cl2的2.63倍,
故答案为:2.63;
(8)阴离子的还原性越弱,则其对应分子的氧化性越强,氧化性强的可以置换出氧化性弱的,故CN2可以置换出(SCN)2,根据Cl2+2KBr=2KCl+Br2进行迁移应用,反应的化学方程式为CN2+2KSCN===2KCN+(SCN)2,
故答案为:CN2+2KSCN===2KCN+(SCN)2。


科目:高中化学 来源: 题型:
【题目】某课外学习小组在学习了![]() 与
与![]() 的反应后,认为
的反应后,认为![]() 与
与![]() 应该也可以反应。他们设计了如图装置
应该也可以反应。他们设计了如图装置![]() 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好![]() 进行实验,探究
进行实验,探究![]() 与
与![]() 反应的产物,请按要求回答下列问题。
反应的产物,请按要求回答下列问题。
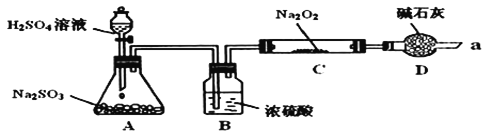
Ⅰ![]() 写出装置A中发生反应的化学方程式:______。
写出装置A中发生反应的化学方程式:______。
Ⅱ![]() 装置D的作用:除了可以防止空气中的
装置D的作用:除了可以防止空气中的![]() 、水蒸气等进入C中与
、水蒸气等进入C中与![]() 反应,还可以______________________________________________________。
反应,还可以______________________________________________________。
Ⅲ![]() 在通入足量的
在通入足量的![]() 与
与![]() 充分反应后,他们对C中固体产物提出如下假设:
充分反应后,他们对C中固体产物提出如下假设:
假设1:只有![]() ;
;
假设2:___________;
假设3:既有![]() ,又有
,又有![]() 。
。
(1)若假设2成立,写出![]() 与
与![]() 反应的化学方程式:_________________。
反应的化学方程式:_________________。
(2)某同学设计了如下实验进一步确认产物的成分。
实验步骤 | 现象 |
| 固体全部溶解 |
| 酸性 |
| 产生白色沉淀 |
步骤![]() 中将产生的气体通入少量酸性
中将产生的气体通入少量酸性![]() 溶液中,发生反应的离子方程式为:______。通过上述实验现象确定假设______成立。
溶液中,发生反应的离子方程式为:______。通过上述实验现象确定假设______成立。![]() 选填1、2或
选填1、2或![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠和钠的化合物有许多重要的用途。
(1)碳酸钠可用于从海水提取溴,涉及的反应如下:3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3,在上述反应中用双线桥法标出电子转移的方向和数目_______________;该反应中氧化剂与还原剂的物质的量之比是 __________。
(2)少量的钠应保存在_________中;钠着火时应采取的灭火措施是_______。
(3)过氧化钠作潜艇供氧剂时发生的化学反应方程式是__________________;该反应的氧化产物是_____________。
(4)厨房中存放的纯碱和小苏打无法用外观区别时,请你设计用厨房现有的物质来区分它们的方法_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2CO3和NaHCO3的混合物5.48g加热到质量不再减轻时,测得残留固体4.24g。另取一定质量的此混合物固体,跟 100 mL某浓度的盐酸刚好完全反应,并收集到 672 mL CO2气体(标准状况下),求;
(l)此混合物中NaHCO3的质量分数____;
(2)所用盐酸的物质的量浓度____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一真空瓶质量为m1,该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3。已知空气相对分子质量为29,则A的相对分子质量是_______________
(2)把一定量铁粉放入氯化铁溶液中,完全反应后,得到溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为___________
(3)已知铜和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,则被氧化的物质与被还原的物质质量比为___________
(4)A、B两个烧瓶中分别装80mL 3.0 mol/L的盐酸和NaOH溶液,再分别加等质量的铝粉,在相同状况下产生的气体的体积比为A:B=2:5,则加入铝粉的质量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______,加铁粉后溶液增重的是____;
(2)向Fe2+的溶液中滴加NaOH溶液,现象是__________________。
(3)除去FeCl2中FeCl3中所涉及的离子方程式:________________。
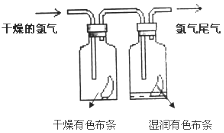
II.(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是:____________,该实验证明起漂白作用的是______。(填化学式)
(2)①氯气有毒,实验室吸收多余的氯气的原理是(用离子方程式表示)__________________;
②根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_________(填化学式)。
③长期露置于空气中的漂白粉会失效,失效的原因是(用化学方程式表示)___________________________,________________________。
④漂白粉是否完全失效可用稀盐酸检验,加稀盐酸后产生的气体是______(填字母代号)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com