
MnO2�ڹ�ҵ�Ͼ��й㷺����;�����������ɵ��ȥ�������ϳɹ�ҵ�Ĵ�������������������ҵ���´ɹ�ҵ����ɫ������ɫ�����������ȡ�
I.��ʵ�����У�������MnO2���ֽ�H2O2��KClO3�Ʊ�O2��
��1����Ƽ�ʵ����֤MnO2��H2O2�ķֽ��������________��
��2�������MnO2���ֽ�KCIO3�Ʊ����ռ�O2��Ӧѡ�õ�ʵ��װ����_______��
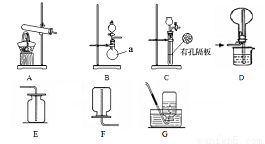
����Bװ���Ʊ�������NH3����a��ʢ�ŵ�ҩƷ��_______��
II.MnO2��ʵ�����г�������������ij��ѧ��ȤС��̽���ڳ����£�MnO2�ܷ���������NaI��Һ����ѡ�õ��Լ��������У�0.5mol/LNaI��Һ��ϡ���ᡢϡ���ᡢCCl4���ƾ�����Һ©�����ձ���©�������������ƾ��ơ��¶ȼơ�ţ�ǹܡ���ƿ��ʯ����������̨������Ȧ�����У���
ʵ��IJ������£�
����С�ձ��м���15mLNaI��Һ��������ʹ���ữ����������MnO2����ֽ��衣
�ڽ�������Һ���ˣ��۲���Һ��ɫ��
������Һ�м���5mL��ȡ���������
����������̨��Ȧ�Ͼ��á�
�ݷ�Һ��
���²�õ��ĺ�I2��Һ��������ʹ�õ�����I2��
��ش��������⣺
��1��д��������з��������ӷ���ʽ___________��
��2���۲첽���������Һ����ɫΪ_______�������ж��е���I2���ɡ�
��3����ȡ��Һ�еĵⵥ�����õ���������Ϊ_______��ѡ�����ȡ����______��
��4������ܾ��ú۲쵽��������_______��
��5��������Һ�IJ�����________��
��6�����������װ����װ�û�ȱ�ٵ�������___________��
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ�Ͼ��С��γ��и����ڶ���ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Cl2����ijЩ�����л���ʱ�����������HCl���������·�Ӧ����ʵ���ȵ�ѭ�����ã�
4HCl(g)+O2(g)  2Cl2(g)+2H2O(g) ��H=-115.6 kJ��mol-1
2Cl2(g)+2H2O(g) ��H=-115.6 kJ��mol-1
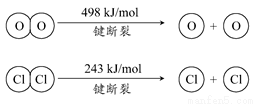
����˵����ȷ����
A. �����¶������HCl��ת����
B. �����������ʹ�÷�Ӧ���ʱ��С
C. 1molCl2ת��Ϊ2molCl2ԭ�ӷų�243kJ����
D. ����H2O(g)��1mol H-O���ȶ���HCl(g)��1mol H-Cl������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ�����и߶���ѧ�ڵ�һ�ν�ѧ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
���и��������У�һ���Ȳ���ͬϵ��ֲ���ͬ���칹�����( )
A. CH4��C4H10
B. ����ͼ������
C. 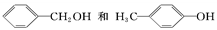
D. 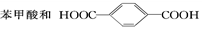
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�챱���к���������3����Ӧ�Կ��ԣ���ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ��ƶ���
ҩ��Targretin(F)��������ͬ��Ƥ��T-ϸ���ܰ�������ϳ�·������ͼ��ʾ��
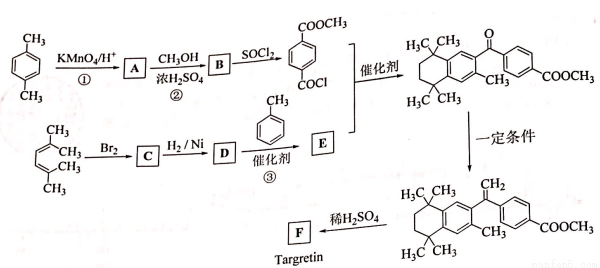
��֪��i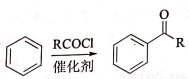 ii
ii 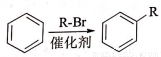
iii RCOOH  RCOCl��R��ʾ��������
RCOCl��R��ʾ��������
(1)��Ӧ�ٵķ�Ӧ������______________��(2)��Ӧ�ڵĻ�ѧ����ʽ��______________��
(3)C�Ľṹ��ʽ��______________��
(4)��Ӧ�۵Ļ�ѧ����ʽ��______________��
(5)F�ķ���ʽ��C24H28O2��F�к��еĹ����ţ�______________��
(6)д��������������A������ͬ���칹��Ľṹ��ʽ��������-O-O-��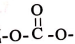 �ṹ��____________��
�ṹ��____________��
a�������ϵ�һ�ȴ��������� b�����ܷ���������Ӧ���ܷ���ˮ�ⷴӦ
(7)��֪: 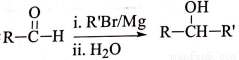 R-CH��R�䣨R��R��Ϊ������
R-CH��R�䣨R��R��Ϊ������
��2 -��������ϩΪԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�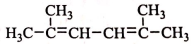 ��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������_________
��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�챱���к���������3����Ӧ�Կ��ԣ���ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������г������ʵ���;���仹ԭ���йص���

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�������������Ĵ����������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�л���X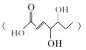 ��һ����Ҫ���л��ϳɵ��м��壬�����йظ����ʵ�������ȷ����
��һ����Ҫ���л��ϳɵ��м��壬�����йظ����ʵ�������ȷ����
A. X�ķ���ʽΪC7H10O4
B. X��ʹ��ˮ������KMnO4��Һ��ɫ����ԭ����ͬ
C. 1molX������Na��Ӧ��������33.6L�����������
D. 1molX�����Ժ�2molH2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ��«���и�����һ��ģ�⿼�����ۻ�ѧ�Ծ� ���ͣ������
����̬�ĵ���һϵ��ת�����Եõ����ᣬ����ͼ��ʾ��
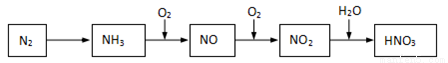
(1)NH3��O2�ڴ��������·�Ӧ���仯ѧ����ʽ��______________��
(2)NO2��HNO3��Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ________________��
(3)2NO(g)+O2(g)  2NO2(g)�������������Ҫ��Ӧ֮һ����800��ʱ�����ݻ�Ϊ1L���ܱ������г���0.010molNO��0.005molO2����Ӧ������NO��Ũ����ʱ��仯����ͼ��ʾ��
2NO2(g)�������������Ҫ��Ӧ֮һ����800��ʱ�����ݻ�Ϊ1L���ܱ������г���0.010molNO��0.005molO2����Ӧ������NO��Ũ����ʱ��仯����ͼ��ʾ��
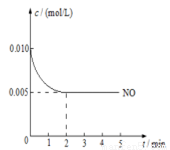
��2min�ڣ�v(O2)=________mol/(L��min)
��800��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ__________��
���жϸ÷�Ӧ�ﵽƽ��������ǣ�д��2�����ɣ�____________��
����֪����.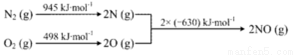
��.N2(g)+2O2(g)=2NO2(g) ��H=+68kJ��mol-1��д��NO����NO2�Ȼ�ѧ����ʽ_____________���¶ȶ���NO����NO2ƽ��ת���ʵ�Ӱ���ǣ�___________________��
(4)��ⷨ����������������������Ի������ᡣʵ����ģ���ⷨ����NO��װ����ͼ��ʾ����Ϊʯī�缫������д���缫������NOת��Ϊ����ĵ缫��Ӧʽ��______________��
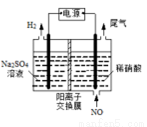
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ�߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��Na��Mg��Al���й����ʵ�������ȷ����
A. ���ԣ�NaOH��Mg��OH��2��Al��OH��3 B. ��һ�����ܣ�Na��Mg��Al
C. �縺�ԣ�Na��Mg��Al D. ��ԭ�ԣ�Na��Mg��Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ3���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪A2�����ӹ�����x�����ӣ�AԪ�ص�������Ϊm����n��A2�����ӹ����е��ӵ����ʵ���Ϊ��������
A. 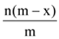 B.
B. 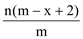 C.
C. 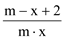 D.
D. 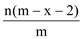
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com