
| A. | 化学反应不一定伴随着能量的变化 | |
| B. | 氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=571.6kJ•mol-1 | |
| C. | 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 | |
| D. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
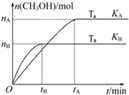 一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:
一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
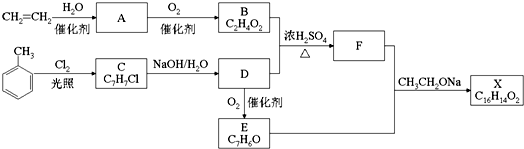
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O. _.
_. CH2OCH2CH2CHO B.
CH2OCH2CH2CHO B. CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3
COOCH2CH2CH3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:Al>Mg | B. | 水溶性:CH3CH2OH>CH3CH2OCH2CH3 | ||
| C. | 沸点:HCl>HF | D. | 晶格能:NaCl>MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氧化还原反应与放热反应属于包含关系 | |
| B. | 溶液与胶体属于并列关系 | |
| C. | 化合物与碱性氧化物属于交叉关系 | |
| D. | 化合物与电解质属于重叠关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2和N2O4的混合气体中,NO2的体积分数是80% | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| C. | 该合金中铜与镁的物质的量之比是2:1 | |
| D. | 得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.36 g•L-1 | B. | 0.58 g•L-1 | C. | 1.16 g•L-1 | D. | 0.714 g•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com