


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
| H2SO4 |
| NH3?H2O |
| △ |
| H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
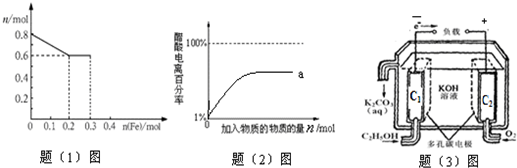
| 醋酸浓度(mol?L-1) | 1 | 0.1 | 0.01 |
| pH值 | 2.50 | 3.00 | 3.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
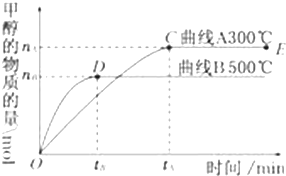 (1)一定条件下,在体积为4L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).
(1)一定条件下,在体积为4L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠加入滴有酚酞的水中,溶液变红:Na+2H2O═Na++2OH-+H2↑ |
| B、用NaOH溶液吸收多余的氯气:Cl2+2OH-═Cl-+ClO-+H2O |
| C、将NaHCO3溶液和过量Ca(OH)2溶液混合有白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| D、将醋酸溶液滴到大理石上有气泡产生:2H++CaCO3═CO2↑+Ca2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水 |
| B、检验溶液中是否含有SO42-:先滴加氯化钡溶液,再滴加稀盐酸 |
| C、检验溶液中是否含有Fe2+:先滴加氯水,再滴加KSCN溶液 |
| D、检验溶液中是否含有NH4+:先滴加浓NaOH溶液并加热,再用湿润的红色石蕊试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2可使酸性高锰酸钾褪色 | SO2有漂白性 |
| B | 浓硫酸具有脱水性和强氧化性 | 浓硫酸滴到湿润的蔗糖中,蔗糖变 成黑色海绵状 |
| C | SiO2有导电性 | SiO2可用于制备光导纤维 |
| D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | Ksp(BaSO4)<Ksp(BaCO3) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com