
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,
在催化剂作用下反应生成甲醇,
平衡转化率与温度、压强的关系如图所示。

①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。
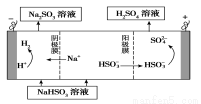
请写出开始时阳极反应的电极反应式________________。
(1)-90.1(2分)(2)ac(2分)
(3)①小于(1分) ②(V/a)2 (2分) ③增大(1分)
(4)①SO2+2H2O-2e-===4H++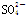 (2分)
(2分)
② +H2O-2e-===
+H2O-2e-===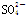 +3H+(2分)
+3H+(2分)
【解析】
试题分析:(1)根据已知的热化学方程式和盖斯定律可知,②+③×2-①即得到CO(g)+2H2(g)=CH3OH(g),所以该反应的反应热△H=-283.0kJ/mol-285.8kJ/mol×2+764.5kJ/mol=-90.1kJ/mol.
(2)a.使用高效催化剂可以加快反应速率,a正确;b.降低反应温度,反应速率降低,b不正确;c.增大体系压强,反应物的浓度增大,反应速率加快,c正确;d.不断将CH3OH从反应混合物中分离出来,降低生成物浓度,反应速率降低,d不正确,答案选ac。
(3)①根据图像可知,在温度相同时,P2曲线所在的CO转化率大于P1曲线所在的CO转化率。由于正方应是体积减小的可逆反应,增大越强平衡向正反应方向移动,CO的转化率增大,所以P1小于P2。
②由于平衡常数与压强没有关系,所以根据图像可知,在100℃P1时,CO的转化率是0.5,则
CO(g)+2H2(g)=CH3OH(g)
起始浓度(mol/L) 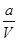
 0
0
转化浓度(mol/L) 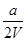
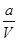
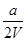
平衡浓度(mol/L) 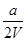
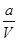
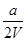
所以平衡常数K=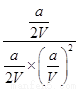 -=(
-=(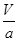 )2
)2
③在其它条件不变的情况下,再增加a mol CO和2a mol H2,相当于是增大体系的压强,平衡向正反应方向进行,达到新平衡时,CO的转化率增大。
(4)①原电池中负极失去电子,发生氧化反应,所以SO2在负极通入,被氧化生成硫酸,负极电极反应式是SO2+2H2O-2e-=4H++SO42-。
②电解池中阳极与电源的正极相连,失去电子,发生氧化反应。所以阳极是HSO3-失去电子被氧化生成
SO42-,则阳极电极反应式是HSO3-+H2O-e-=SO42-+3H+。
考点:考查盖斯定律的应用、外界条件对反应速率和平衡状态的影响、平衡常数的计算、电极反应式的书写


科目:高中化学 来源:2015届黑龙江省高一上学期期中考试化学试卷(解析版) 题型:选择题
在试管的内壁附着下列物质,用稀盐酸浸泡而不能除去的是
A.用足量一氧化碳还原氧化铁后留下的物质
B.用足量氢气还原氧化铜后留下的红色物质
C.盛石灰水后留下的白色固体
D.硫酸铁溶液与氢氧化钠溶液反应后留下的红褐色固体
查看答案和解析>>
科目:高中化学 来源:2015届青海省西宁市高三上学期第一次月考理综化学试卷(解析版) 题型:选择题
有关下列图象的说法正确的是

A.图甲中的曲线可以表示某化学平衡体系改变温度后反应速率随时间的变化
B.图乙中①、②曲线分别表示反应M(g)+N(g)→Q(g),ΔH>0使用和未使用催化剂时,反应过程中的能量变化
C.图丙中的曲线可表示向一定量的氢氧化钠溶液中滴加一定浓度盐酸时的pH变化
D.图丁中开关K置于a或b处均可减缓铁的腐蚀
查看答案和解析>>
科目:高中化学 来源:2015届陕西省宝鸡市岐山县高三上学期期中考试化学试卷(解析版) 题型:选择题
下列实验中,不能达到目的的是

A.实验室用大理石与盐酸制取CO2
B.制取SO2并检验SO2的漂白性
C.分离淀粉胶体和泥沙的混合物
D.比较氯碳硅三种元素的非金属性强弱
查看答案和解析>>
科目:高中化学 来源:2015届陕西省宝鸡市岐山县高三上学期期中考试化学试卷(解析版) 题型:选择题
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
A.两种气体的压强相等 B.O2比O3的质量小
C.两种气体的分子数目相等 D.两种气体的氧原子数目相等
查看答案和解析>>
科目:高中化学 来源:2015届陕西省高二下学期期末考试化学试卷(解析版) 题型:选择题
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物。下列有关判断正确的是

A.简单氢化物的热稳定性:C>A
B.最高价氧化物对应水化物的酸性:D<C
C.B的最高价氧化物的水化物能与C的最高价氧化物的水化物反应
D.A、C、D的含氧酸的钠盐水溶液可能均显碱性
查看答案和解析>>
科目:高中化学 来源:2015届陕西省高二下学期期末考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是
A.使酚酞试液变红的溶液中:S2-、 、
、 、Na+
、Na+
B.由水电离出来的c(H+)=10-12mol/L的溶液中:Na+、 、
、 、K+
、K+
C.pH=0的溶液中:Na+、K+、Fe2+、
D.pH=7的溶液中:Al3+、Cl-、 、
、
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高三上期第一次月考理综化学试卷(解析版) 题型:选择题
利用实验器材(规格和数量不限)能够完成相应实验的一项是
选项 | 实验器材(省略夹持装置) | 相应实验 |
A | 三脚架、泥三角、坩埚、坩埚钳 | 煅烧石灰石制取生石灰 |
B | 烧杯、玻璃棒、胶头滴管、100 mL容量瓶 | 用浓盐酸配制100mL 0.1 mol·L-1的稀盐酸溶液 |
C | 烧杯、玻璃棒、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
D | 烧杯、酸式滴定管、碱式滴定管 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.32 g O2占有的体积约为22.4 L
B.22.4 L N2含阿伏加德罗常数个氮分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com