
| A. | 12gC所具有的能量一定高于28gCO所具有的能量 | |
| B. | 56gCO和32gO2所具有的总能量大于44gCO2所具有的总能量 | |
| C. | 12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 | |
| D. | 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 |
分析 根据放热反应中反应物总能量大于生成物总能量,等量的物质完全燃烧时放出的热量大于不完全燃烧时的热量,据此来解答.
解答 解:A、因2C+O2=2CO是放热反应,所以12gC和16gO2所具有的总能量一定高于28gCO所具有的能量,故A错误;
B、因2CO+O2═2CO2是放热反应,所以56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量,即反应物的总能量大于生成物的总能量,故B正确;
C、因2C+O2=2CO,2CO+O2═2CO2都是放热反应,所以C+O2=CO2也是放热反应,所以12gC和32O2所具有的总能量一定高于44gCO2所具有的总能量,故C正确;
D、因物质完全燃烧放出的热量比不完全燃烧放出热量多,所以一定质量的碳燃烧,生成CO2比生成CO时放出的热量多,故D正确;
故选A.
点评 本题考查了放热反应,解此类题要明确,反应物能量是指所有反应物的总能量和,生成物能量是指所有生成物总能量和,而不是某一个反应物和某一个生成物能量进行对比.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/mm | 0.160 | 0.089 | 0.143 | 0.102 | 0.074 |
| 化合价 | +2 | +2 | +3 | +6,-2 | -2 |
| A. | L、M的单质与稀盐酸反应速率L<M | |
| B. | Q、T两元素间可形成两性化合物 | |
| C. | R、T两元素的氢化物分子间能形成氢键 | |
| D. | L、R两元素的简单离子的核外电子数可能相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,N2、H2和NH3的物质的量之比为1:3:2 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| C. | 达到化学平衡时,N2不能完全转化为NH3 | |
| D. | 达到化学平衡时,容器中气体的总压强不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
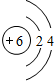 .
. ;写出C2B2的电子式
;写出C2B2的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:| 时间(s) 物质的量浓度(mol/L) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | 容器中各组分的体积分数不随时间变化容器内 | |
| C. | AB的消耗速率等于A2的消耗速率 | |
| D. | 3种气体AB、A2、B2共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验操作 | 预期现象及结论 |
| 1 | 取少量所得溶液于试管中, 再滴入几滴稀盐酸 | 若无气泡产生,证明原溶液中不含有Na2CO3 |
| 2 | 另取少量所得溶液于试管中, 再滴入几滴Na2CO3溶液 | 若无沉淀产生,结合步骤1,猜想一成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Co(NH3)4 Cl2]Cl | B. | [Cu(NH3)4]Cl2 | C. | [Co(NH3)6]Cl3 | D. | [Co(NH3)3 Cl3] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com