
(双选)在1 L密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
|
时间 |
c(NH3) (mol/L) |
c(O2 ) (mol/L) |
c(NO) (mol/L) |
|
起始 |
0.8 |
1.6 |
0 |
|
第2min |
0.6 |
a |
0.2 |
|
第4min |
0.3 |
0.975 |
0.5 |
|
第6min |
0.3 |
0.975 |
0.5 |
|
第8min |
0.7 |
1.475 |
0.1 |
|
第10min |
0.7 |
1.475 |
0.1 |
下列说法错误的是
A.反应在第2 min到第4min时,O2 的平均反应速率为0.1875 mol/(L·min)
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min时、第8 min时分别达到化学平衡,且平衡常数不相同
D.在开始反应的前2 min内,该反应的△H=-0.05Q kJ·mol-1
BD
【解析】
试题分析:先由△c÷△t的定义式直接求v(NH3)或v(NO),再由系数比规律间接求v(O2),则v(O2)=0.3mol/L÷2min×5/4=0.1875 mol/(L·min),故A正确;催化剂能加快反应速率,使c(NH3)的消耗速率增大,虽然升温也能加快反应速率,但也能使平衡左移,使c(NH3)增大,故B错误;第4 min时、第8 min时分别达到化学平衡,由于c(H2O)=6c(NO)/4,则平衡常数分别为(0.54×0.756)/(0.34×0.9755)、(0.14×0.156)/(0.74×1.4755),前者大于后者,故C正确;在开始反应的前2 min内,△c(NH3)=0.2mol/L,则消耗0.2mol NH3,设放出的热量为xkJ,所以4/0.2=Q/x,则x=0.05Q,因此该反应的△H仍是-Q kJ·mol-1,故D错误。
考点:考查化学反应速率的计算、影响化学反应速率和化学平衡的因素、化学平衡常数的计算、化学反应的焓变与热量变化等知识。


科目:高中化学 来源: 题型:
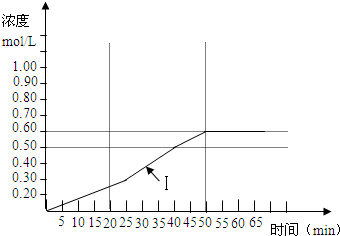
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 |
| SO3 浓度(mol/L) |
0 | 0.1 | 0.15 | 0.20 | 0.25 | 0.30 | 0.35 | 0.40 | 0.50 | 0.55 | 0.60 | 0.60 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol/L) | 0 | 0.2 | 0.30 | 0.40 | 0.50 | 0.50 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol/L) | 0 | 0.25 | 0.35 | 0.35 | 0.35 | 0.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.3mol.L-1, | B、X2为0.2mol.L-1, | C、Y2为0.3mol.L-1, | D、Z为0.4mol.L-1, |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省广州六中高二上学期期末考试理科化学试卷(带解析) 题型:填空题
已知CO2可以生产绿色燃料甲醇。CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
(1)使用催化剂I时,反应在10小时内的平均反应速率:V(H2)= ______mol.(L.h)-1。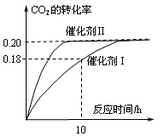
(2)下列叙述正确的是______。(双选)
A.当容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充入氩气増大压强有利于提髙CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂II比催化剂I高
D.催化效率:在上述反应条件下,催化剂II比催化剂I高
(3)根椐图中数据,计算此反应在3000C时的平衡常数。(写出计箅过程)
(4)将上述平衡体系升温至400°C, 平衡常数:K(4000C) ______ K(3000C) (填<、=或> )。
(5)其它条件不变,若上述反应在催化剂Ⅱ,400°C下达到平衡,请在上图画出CO2转化率随时间变化图。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省清远市高三上学期期末检测理综化学试卷(解析版) 题型:计算题
能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g)
2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
② H2O(l) H2O(g)
△H=+ 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
(2)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。

①在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂。
②能判断该反应在“图2”所在条件下是否已达化学平衡状态的依据是 。(双选)
A.容器中压强不变 B.体系的密度不随时间改变
C.v正(H2)=2v逆(CH3OH) D.CO与H2的物质的量的比不随时间改变
③计算该温度下CO(g)+2H2(g) CH3OH(g)的化学平衡常数K=
。
CH3OH(g)的化学平衡常数K=
。
④请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(3)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6。现将c mol·L-1 CaCl2溶液与2.00×10-2 mol·L-1 Na2SO4溶液等体积混合生成沉淀,则c的最小值是 (结果保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com