
| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Na2O2和足量CO2反应转移2 NA个电子 | |
| C. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
分析 A、求出钠的物质的量,然后根据1mol钠~0.5mol氢气来分析;
B、过氧化钠与二氧化碳的反应为歧化反应来分析;
C、求出混合气体的物质的量,然后根据氮气和氢气均为双原子分子来分析;
D、根据铁转变为四氧化三铁后,铁的化合价变为+$\frac{8}{3}$价来分析.
解答 解:A、23g钠的物质的量为1mol,而1mol钠~0.5mol氢气,即生成0.5NA个氢气分子,故A错误;
B、过氧化钠与二氧化碳的反应中,1mol过氧化钠中其中的1mol氧原子的价态由-1价变为0价,另1mol氧原子的价态由-1价变为-2价,即发生歧化反应,故1mol过氧化钠反应时转移1mol电子,即NA个,故B错误;
C、标况下22.4L混合气体的物质的量为1mol,而氮气和氢气均为双原子分子,故1mol混合物中含2mol原子即2NA个,故C错误;
D、由于铁转变为四氧化三铁后,铁的化合价变为+$\frac{8}{3}$价,故3mol铁转移8mol电子即8NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂 | |
| B. | 在任何条件下都不能发生Cu+H2SO4═CuSO4+H2↑反应 | |
| C. | 浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 | |
| D. | 二氧化氮与水反应的离子方程式是3NO2+H2O═2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N和P同一主族,其简单氢化物的沸点NH3>PH3 | |
| B. | 0.5摩尔氧化钠和过氧化钠的混合物中阴阳离子的总数为1.5NA | |
| C. | 在标准状况下22.4L SO3的物质的量约为1摩尔 | |
| D. | 已知P4分子是正四面体结构,31g白磷中含有1.5NA个P-P非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
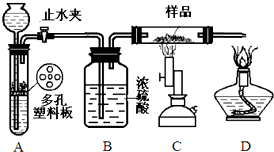
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
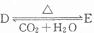 ,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可简写为
可简写为
 ,系统命名为甲苯.
,系统命名为甲苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:Br2>Cl2 | B. | 稳定性:HCl>HBr | ||
| C. | 酸性:H2SiO3>H2SO4 | D. | 碱性:Mg(OH)2<NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com