


科目:高中化学 来源: 题型:
| A、.稀释浓硫酸时将水沿器壁缓慢注入浓硫酸中,同时不断搅拌 |
| B、.过滤时,滤纸的边缘要高于漏斗的边缘 |
| C、.胶头滴管的尖嘴部分直接伸入试管里滴加液体 |
| D、实验室取用液体药品做性质实验时,如果没有说明用量,一般取1~2mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、73% | B、36% |
| C、24% | D、12% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
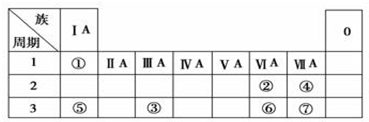
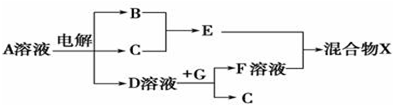
查看答案和解析>>
科目:高中化学 来源: 题型:
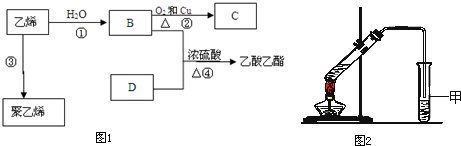
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com