
【题目】化合物H是一种光伏材料中间体。工作室由芳香化合物A制备H的一种合成路线如下:

已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题
(1)B所含官能团名称为___________。
(2)由B生成C和E生成F的反应类型分别为___________、___________。
(3)D的结构简式为___________。
(4)由A生成B的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,符合要求的X的结构有___________种,写出其中一种结构简式___________。
(6)根据已有知识并结合相关信息,写出以乙醇为原料合成 CH3CH2CH2COOH的合成路线(无机试剂在用)(合成路线示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH ______________________________________________。
CH3CH2OH ______________________________________________。
【答案】碳碳双键、醛基 氧化反应 取代反应(或酯化反应) ![]()
![]() 4种
4种 

【解析】
芳香族化合物A与乙醛发生信息①中的反应生成B,A含有醛基,反应中脱去1分子水,由原子守恒可知A的分子式为:C9H8O+H2O-C2H4O=C7H6O,故A为![]() ,则B为
,则B为![]() ,B发生氧化反应、酸化得到C为
,B发生氧化反应、酸化得到C为![]() .C与溴发生加成反应得到D为
.C与溴发生加成反应得到D为![]() ,D发生消去反应、酸化得到E为
,D发生消去反应、酸化得到E为![]() .E与乙醇发生酯化反应生成F为
.E与乙醇发生酯化反应生成F为![]() .结合信息②中的加成反应、H的结构简式,可推知G为
.结合信息②中的加成反应、H的结构简式,可推知G为 ,以此解答(1)~(5);
,以此解答(1)~(5);
(6)利用信息①增长碳链,乙醇催化氧化生成乙醛,2分子乙醛反应得到CH3CH=CHCHO,再与氢气发生反应得到CH3CH2CH2CH2OH,最后用酸性高锰酸钾溶液氧化得到CH3CH2CH2COOH。
(1)由分析可知,B为![]() ,所含官能团名称为碳碳双键和醛基。
,所含官能团名称为碳碳双键和醛基。
(2)![]() 发生氧化反应生成的C为
发生氧化反应生成的C为![]() ;E为
;E为![]() ,其与乙醇发生酯化反应生成的F为
,其与乙醇发生酯化反应生成的F为![]() ,反应类型为取代反应;
,反应类型为取代反应;
(3)由分析可知D的结构简式为![]() ;
;
(4)A为![]() ,与乙醛在NaOH的水溶液中发生反应生成的B为
,与乙醛在NaOH的水溶液中发生反应生成的B为![]() ,反应的化学方程式为
,反应的化学方程式为![]() ;
;
(5)F为![]() ,芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,说明含有羧基,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1
,芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,说明含有羧基,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1 ;
;
(6)利用信息①增长碳链,乙醇催化氧化生成乙醛,2分子乙醛反应得到CH3CH=CHCHO,再与氢气发生反应得到CH3CH2CH2CH2OH,最后用酸性高锰酸钾溶液氧化得到CH3CH2CH2COOH.合成路线流程图为: 。
。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式是 。
(2)已知:C(s)+ O2(g)![]() CO2(g) ΔH=-437.3 kJmol-1
CO2(g) ΔH=-437.3 kJmol-1
H2(g)+ ![]() O2(g)
O2(g)![]() H2O(g) ΔH=-285.8 kJmol-1
H2O(g) ΔH=-285.8 kJmol-1
CO(g)+ ![]() O2(g)
O2(g)![]() CO2(g) ΔH=-283.0 kJmol-1
CO2(g) ΔH=-283.0 kJmol-1
则煤的气化主要反应的热化学方程式是
C(s)+ H2O(g)![]() CO(g)+ H2(g) ΔH= kJmol-1。
CO(g)+ H2(g) ΔH= kJmol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(结构如图)是一种历史悠久的解热镇痛药,诞生于1899年3月6日。用于治感冒、发热、头痛、牙痛、关节痛、风湿病,还能抑制血小板聚集,用于预防和治疗缺血性心脏病、心绞痛、心肺梗塞、脑血栓形成,应用于血管形成术及旁路移植术也有效。
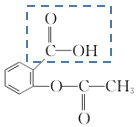
(1)阿司匹林水溶液呈_____(填“酸性”、“碱性”、“中性”)。
(2)阿司匹林分子中虚线框内官能团的名称______(填名称)。
(3)阿司匹林必须密闭干燥存储,以防止在酸性条件下与水发生_______ 生成乙酸和水杨酸( ![]() )
)
A.水解反应 B.加成反应 C.酯化反应
(4)向阿司匹林水溶液中滴加饱和NaHCO3溶液,实验现象为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,以钛铁矿(主要含FeTiO3,还含有Fe2O3 和Al2O3、SiO2等杂质)为原料制备二氧化钛并得到副产品绿矾(FeSO4·7H2O)的工艺流程如下图所示。

已知:TiO2+在一定条件下会发生水解。
回答下列问题:
(1)要提高酸浸时钛矿石的溶解速率,可行的措施是(写一条即可)_______________。黑钛液中生成的主要阳离子有TiO2+和Fe2+,步骤①主要反应的化学方程式是_________。
(2)步骤②中,加入铁粉的主要作用是_____,同时也会将部分TiO2+还原为Ti3+。
(3)向滤液2中通入空气的目的是______(用离子方程式表示)。
(4)请结合化学用语用化学平衡理论解释步骤④中加入热水稀释将TiO2+转化为Ti(OH)4 的原因:_________________。
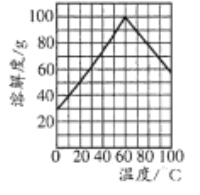
(5)副产品绿矾中含有杂质[Al2(SO4)3]。要将副产品进一步提纯,请结合右图的绿矾溶解度曲线完成提纯过程:将副产品溶于稀硫酸中,充分搅拌后,用NaOH溶液调节反应液的pH约为5,过滤沉淀后得到FeSO4溶液,______,过滤,用冰水洗涤,低温干燥,得到FeSO4·7H20晶体。
(6)用氧化还原滴定法测定制备得到的产品中TiO2的质量分数:在一定条件下,将一定量的产品溶解并将TiO2还原为Ti3+,再以KSCN溶液作为指示剂,用硫酸铁铵[NH4Fe(SO4)2]标准溶液滴定Ti3+至全部生成Ti4+。
①滴定终点的现象是_______________。
②滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol/L NH4Fe(SO4)2标准溶液24.00mL,则TiO2的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是( )
A.将pH=2的酸溶液稀释10倍,溶液的pH一定变为3
B.将pH=2的盐酸溶液和pH=4的盐酸溶液等体积混合后,溶滚的pH变为3
C.将pH=12的Ba(OH)2溶液稀释10倍,溶液的pH变为13
D.将pH=a的盐酸与pH=b的NaOH溶液等体积混合后,若pH=7, 则a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)__________________________。
(2)上述B步骤操作的目的是__________________________________________。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果______(填“偏高“、“偏低”或“不变”)
(4)判断到达滴定终点的实验现象是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是
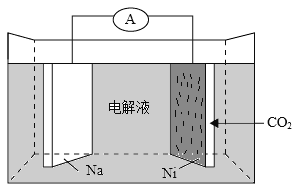
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,对CO、NOx的综合利用是科学家研究的热点。回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) H1=+180.5kJ·mol-1
2CO(g)+O2(g)=2CO2(g) H2=-566kJ·mol-1
2NO(g)+O2(g)=2NO2(g) H3=-116.2kJ·mol-1
写出CO和NO2反应生成N2的热化学方程式:____。
(2)制备AlCl3的实际生产过程中,常加入足量的碳粉,反应后生成CO(g)。T℃时,向恒容密闭容器中加入3mol Al2O3(s)、8mol C(s)和3.3mol Cl2(g),发生反应。Cl2的浓度变化如图1所示;图2为20min后改变容器中条件,平衡体系的反应速率(v)随时间(t)的变化关系,且四个阶段都各改变一种不同的条件。

①容器中发生反应的化学方程式为___。
②0~15min内,该反应的平均速率v(CO)=___mol·L-1·min-1。
③T℃时,该反应的平衡常数K=___。
④15min时的平衡常数K(15)、44 min时的平衡常数K(44)与55min时的平衡常数K(55)的大小关系为____。
(3)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g)。一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___(填标号)。
4NO2(g)+O2(g)。一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___(填标号)。
A.容器中气体的密度不发生变化
B.NO2和O2的体积比保持不变
C.v正(NO2)=2v逆(N2O5)
D.气体的平均相对分子质量为43.2,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
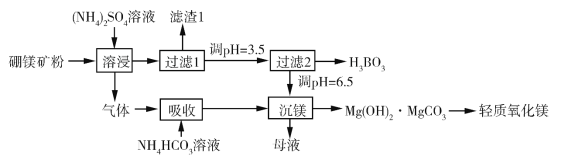
回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com