
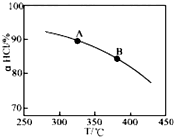
 用O2将HCl转化为Cl2,可提高效益,减少污染,
用O2将HCl转化为Cl2,可提高效益,减少污染,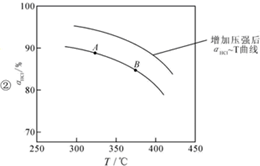 增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.
增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
分析 (1)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+$\frac{1}{2}$O2(g)=CuO(s)+Cl2(g)△H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式;
(2)①由图可知,温度越高,平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动;
②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大;
③改变措施有利于提高αHCl,应使平衡向正反应方向移动,注意不能只增加HCl的浓度;
(3)根据v=$\frac{△n}{△t}$计算2.0~6.0min内v(Cl2),再利用速率之比等于其化学计量数之比计算v(HCl);
(4)氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水.
解答 解:(1)根据图象信息,箭头指向的是生成物可写出反应②的热化学方程式:CuCl2(g)+$\frac{1}{2}$O2(g)?CuO(s)+Cl2(g)△H2,则①+②可得总反应2HCl(g)+$\frac{1}{2}$O2(g)?H2O(g)+Cl2(g),△H=△H1+△H2,故答案为:2HCl(g)+$\frac{1}{2}$O2(g)?H2O(g)+Cl2(g),△H=(△H1+△H2)kJ/mol;
(2)①根据图1、2可知随着温度的升高,aHCl减小,说明升高温度,平衡向逆向移动,则可知逆反应吸热反应,所以正反应是放热反应,故△H<0,同时由于升高温度,平衡逆移,则生成物减少,温度是B点大于A点,所以平衡常数K(A)>K(B);故答案为:<;K(A);
②同时由于该总反应是气体系数减小的反应,所以,压缩体积使压强增大,一定温度下,平衡应正向移动,ɑHCl应较题目实验状态下为大,所以可得曲线图: ;故答案为:
;故答案为: 增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大;
增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大;
③A、增大n(HCl),平衡正向移动,但是平衡移动使HCl减少的趋势小于增加HCl使增大的趋势,所以HCl的转化率减小,故A错误;
B、增大n(O2),反应物的浓度增大,平衡向正向移动,HCl转化率增大,故B正确;
C、使用更好的催化剂,不能使化学平衡发生移动,实验HCl的转化率不变,故C错误;
D、移去H2O,及减小了生成物的浓度,平衡向正反应方向移动,HCl转化率增大,故D正确;
故答案为:BD.
(3)题目中给出的是n(Cl2)的数据,要求的是以HCl的物质的量变化表示的反应速率,所以根据方程式进行计算,注意是2.0~6.0min内的速率,单位是mol•min-1:设2.0~6.0min内,HCl转化的物质的量为n,则:
2HCl(g)+$\frac{1}{2}$O2(g)=H2O(g)+Cl2(g)
2 1
n (5.4-1.8)×10-3mol
解得 n=7.2×10-3mol,
所以v(HCl)=$\frac{7.2×1{0}^{-3}mol}{(6.0-2.0)min}$═1.8×10-3mol/min,故答案为:1.8×10-3mol/min;
(4)Cl2与石灰乳发生反应制取漂白粉,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评 本题比较综合,涉及热化学方程式书写、化学平衡及平衡常数影响因素、化学反应速率的计算等,(3)中注意用单位时间内物质的量变化表示速率,较好的考查的分析解决问题的能力,难度中等.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| … | W | ||
| X | Y | … | Z |
| A. | 离子半径:X>Y>Z>W | |
| B. | 气态氢化物的稳定性W>Z | |
| C. | 元素X与Z形成的化合物中只含有离子键 | |
| D. | 最高价氧化物对应水化物的碱性X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 第Ⅱ步的离子方程式为Na++NH3+H2O+CO2→NaHCO3↓+NH4+ | |
| B. | 第Ⅲ步得到的晶体是Na2CO3•10H2O | |
| C. | A气体是CO2,B气体是NH3 | |
| D. | 第Ⅳ步操作的过程主要有溶解、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
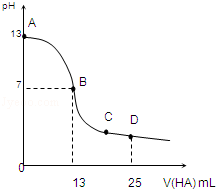 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
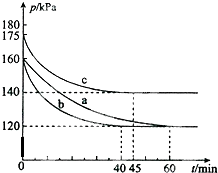 在10L的恒容密闭容器中,发生反应:PCl3(g)+Cl2(g)?PCl5(g)△H<0 若起始时PCl3(g)和Cl2(g)均为0.2mol,在不同条件下进行a、b、c三组实验,每一组实验都是在恒温恒容条件下进行,反应体系总压强随时间的变化如图所示.下列说法中正确的是( )
在10L的恒容密闭容器中,发生反应:PCl3(g)+Cl2(g)?PCl5(g)△H<0 若起始时PCl3(g)和Cl2(g)均为0.2mol,在不同条件下进行a、b、c三组实验,每一组实验都是在恒温恒容条件下进行,反应体系总压强随时间的变化如图所示.下列说法中正确的是( )| A. | 与实验a相比,实验b升高了温度,实验c加入了催化剂 | |
| B. | 从反应开始至刚达平衡时,实验b的化学反应速率ν(PCl5)=5×10-4mol/(L.min) | |
| C. | 实验c达平衡时,PCl3(g)的转化率为 60% | |
| D. | 在实验a条件下,该反应的平衡常数K=100 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、AlO2-、NO3- | B. | NH4+、Al3+、NO3-、SO42- | ||
| C. | K+、NH4+、SO32-、S2- | D. | K+、Ag+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com