
【题目】常温下,NC13是一种油状液体,其分子空间构型为三角锥形,下列对NC13的有关叙述错误的是( )
A.NC13中N—C1键键长比CCl4中C—C1键键长短
B.NC13分子中的所有原子均达到8电子稳定结构
C.NCl3分子是极性分子
D.NBr3的沸点比NCl3的沸点低
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,萘可被浓硝酸和浓硫酸的混合液硝化生成二硝基化合物,它是1,5二硝基萘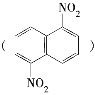 和1,8二硝基萘
和1,8二硝基萘 的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能,利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到1,8二硝基萘,应采用的方法是 ( )
的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能,利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到1,8二硝基萘,应采用的方法是 ( )
A.蒸发浓缩结晶B.向滤液中加水后过滤
C.用Na2CO3溶液处理滤液D.将滤液缓缓加入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如右图所示,下列有关叙述正确的是( )
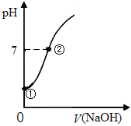
A. ①点所示溶液中只存在HClO的电离平衡
B. ①到②水的电离程度逐渐减小
C. I-能在②点所示溶液中存在
D. ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCl2和NaHCO3按物质的量之比为1:2混合制成溶液,加热蒸干灼烧后得到的固体是( )
A.Mg(HCO3)2、NaClB.MgO、NaClC.MgCl2、Na2CO3D.MgCO3、NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,发生如下反应:4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)
完成下列填空:
(1)写出该反应的平衡常数表达式K=______。若只改变一个影响化学平衡的因素,则下列关于平衡常数K与化学平衡移动关系的叙述正确的是______(填序号)。
a.K值不变,平衡不移动
b.K值变化,平衡一定移动
c.平衡移动,K值可能不变
d.平衡移动,K值一定变化
(2)若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是_____(填序号)。
a.υ正(NO2)=2υ正(NO)
b.NO和Cl2的物质的量之比不变
c.混合气体密度保持不变
d.c (NO2):c (NO):c (Cl2)=4:2:1
(3)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.4mol NO2和适量NaCl固体,10min时反应达到平衡.测得10min内υ(NO2)=0.015mol/(Lmin),则平衡后n (Cl2)=______mol,此时NO2的转化率为а1;保持其它条件不变,扩大容器的体积,当反应再次达到平衡时NO2的转化率为а2,则а2_____а1(选填“>”、“<”或“=”)。
实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得到1L溶液A,溶液B为0.1mol/L的CH3COONa溶液。
(4)两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为________________。
(5)可使溶液A和溶液B的pH相等的方法是__________(填序号)。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂废气中SO2的回收利用方案如图所示。下列说法错误的是( )
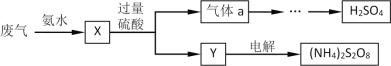
A.X可能含有2种盐B.Y可能含有(NH4)2SO4
C.a是SO3D.(NH4)2S2O8中S的化合价不可能为+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,反应①:I2(aq)+I-(aq)![]() I3-(aq) △H1;反应②: I3-(aq)
I3-(aq) △H1;反应②: I3-(aq) ![]() I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K1 | 1100 | 841 | 680 | 533 | 409 |
请回答:
(1)若反应②的化学平衡常数为K2,在相同温度下,K1·K2=____________。
(2)上述反应①的△H1_______0(填“>”、“=”、“<”);若升高温度,则I2的溶解速率会______(填“加快”、“减慢”或“不变”)。
(3)能判断反应①已达到平衡的依据是_______________
A.容器中的压强不再改变 B.溶液的颜色不再改变
C.I-浓度不再变化 D.正逆反应速率均为0
(4)某温度下,反应①的化学平衡常数为800。在该温度下,向甲、乙、丙三个容器中分别加入I2和I-,这两种物质的起始浓度如下:
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(I2) | 0.1 | 0.2 | 0.2 |
c(I-) | 0.2 | 0.1 | 0.2 |
反应速率最快的是_____________(填“甲”、“乙”或“丙”),平衡时I2的转化率最大的是__________(填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com