
【题目】(1)纯净物可根据其组成和性质进行分类。如图所示的分类方法属于___________(填字母)。
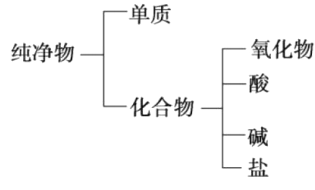
A.交叉分类法 B.树状分类法
(2)人们以______________________为分类标准分出溶液、胶体和浊液三种体系。实验室制备Fe(OH)3胶体的实验步骤是:________________________________________________________________________,请写出实验室制备Fe(OH)3胶体的化学方程式:_________________________________。
(3)以H、O、S、N几种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填在下表相应类别中:
物质类别 | 非含氧酸 | 碱 | 酸式盐 | 酸性氧化物 |
化学式 | ______ | _____ | ____ | _____ |
【答案】B 分散质粒子大小 将56滴饱和FeCl3溶液逐滴加入沸水中,继续煮沸至液体呈红褐色,停止加热 FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl H2S NH3·H2O NH4HSO4、NH4HSO3、NH4HS SO2、SO3、NO 、NO2
Fe(OH)3(胶体)+3HCl H2S NH3·H2O NH4HSO4、NH4HSO3、NH4HS SO2、SO3、NO 、NO2
【解析】
(1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,图示方法就是树状图,选项B正确,合理答案是选项B;
(2)根据分散质粒子直径的大小,将分散系分为溶液、胶体和浊液三种体系;在实验室制备Fe(OH)3的实验步骤是将30mL蒸馏水煮沸,然后将56滴饱和FeCl3溶液逐滴加入沸水中,继续加热煮沸,待液体呈红褐色,停止加热,就得到了Fe(OH)3 胶体;
(3)以H、O、S、N四种元素中任意两种或三种元素可组成的无氧酸有:H2S;碱有:NaOH或NH3H2O;酸式盐有:NH4HS、NH4HSO4、NH4HSO3,氧化物有:H2O、NO、NO2、N2O5、SO2、SO3等。


科目:高中化学 来源: 题型:
【题目】工业上利用空气吹出法提取溴的部分流程如下:

下列说法错误的是()
A. ②中可以采用纯碱溶液,发生的反应是:3Br2+6CO32-+3H2O =5Br-+BrO3-+6HCO3-
B. 第③步,需加入氧化性酸,才能将Br-氧化为Br2
C. B溶液颜色要比A溶液深
D. 第④步,采用的是蒸馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖
其中属于电解质的是___________ ,属于强电解质的是_____________。能导电的是___________。
Ⅱ.胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入___________溶液,继续煮沸至____________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为______________________________________________。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做_______________。
③区分胶体和溶液常用的方法叫做__________。
Ⅲ.①FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为_________________________。
②有学生利用FeCl3溶液制取FeCl36H2O晶体主要操作包括:滴入过量盐酸,______、冷却结晶、过滤。过滤操作除了漏斗、烧杯还需要什么玻璃仪器________________。
③高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误的是
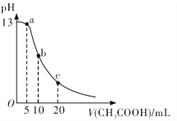
A. a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点处:c(CH3COOH)+c(H+ )=c(OH-)
C. c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或有关物质性质的描述正确的是
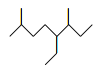
A. 如上图所示的键线式表示的烃的名称为:3-甲基-4-乙基-7-甲基辛烷
B. 符合分子式C3H8O的醇有3种不同的结构
C. 乙烯在一定条件下能发生加成反应、加聚反应,还能被酸性高锰酸钾溶液氧化
D. 治疗疟疾的青蒿素的结构简式为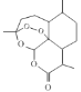 ,分子式是Cl5H20O5
,分子式是Cl5H20O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,其中N的化合价为________,是_____________(用“电解质”或者“非电解质”填空)。NaN3受热分解产生N2和Na,则该反应方程式为: ________。已知常温常压下气体摩尔体积为24.5L/mol,则在常温常压下,反应130g NaN3能产生_____________L的N2。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为________________(已知该反应为置换反应)。若已知2.3gNa完全反应,转移的电子物质的量为____________。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KC1和Na2O,请用单线桥表示该反应电子转移:KClO4+8Na= KCl+4Na2O_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜溶液中加入一小块金属钠后,观察到的现象有
①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体
④钠周围蓝色沉淀部分变黑 ⑤有蓝色沉淀产生 ⑥析出大量红色的铜
⑦小球在溶液中沉浮 ⑧小球在液面上游动、逐渐变小,直至消失
A. ①②③④⑤⑥ B. ①②③④⑤⑧ C. ①②③⑥⑧ D. ②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚(结构简式如图所示》,是一种激素类药物。下列叙述正确的是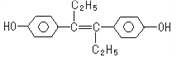
A. 己烯雌酚分子式为C18H12O2
B. 己烯雌酚与NaOH溶液、NaHCO3溶液均能反应
C. 1mol己烯雌酚最多能与4mol溴发生反应
D. 己烯雌酚可以发生加成反应,取代反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅、铜、镓、硒等化学物质可作为制造太阳能电池板的材料。
(1)镓是ⅢA族元素,写出基态镓原子的核外电子排布式__________________。
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由大到小的顺序为______________(用元素符号表示)。
(3)SeO3分子的立体构型为____,与硒同主族元素的氢化物(化学式为H2R)中,沸点最低的物质化学式为____。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的关系如图所示,呈现这种变化的原因是____________。

(5)金属铜投入氨水中或投入过氧化氢溶液中均无明显现象,但投入氨水与过氧化氢的混合液中,则铜片溶解,溶液呈深蓝色,写出使溶液呈深蓝色的离子的化学式_____。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数之比为____________,若该晶体的晶胞边长为a pm,则该合金的密度为________________g·cm-3(列出计算式,不要求计算结果,设阿伏加德罗常数的值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com