
【题目】某有机物的结构式为 ,它在一定条件下能发生的反应有( )
,它在一定条件下能发生的反应有( )
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A. ②③④ B. ①③⑤⑥ C. ①③④⑤ D. ②③④⑤⑥
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】低合金高强度钢是支撑"鸟巢"的铁骨钢筋,除含有铁元素外,还含有Mn(锰),Ti(钛),(铬),(铌)等合金元素,下列有关说法正确的是( )
A. Fe位于元素周期表的第四周期,第VIIIB族
B. 46TiO、 48TiO、50TiO互为同位素
C. Mn 2O7是酸性氧化物
D. ![]() 原子核内有个51个中子,核外有 41个电子
原子核内有个51个中子,核外有 41个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。试回答下列有关的问题:
(1)写出基态D原子的外围电子排布式:______,E元素位于元素周期表______。
(2)A、B、C三种元素的第一电离能最大的是______![]() 用元素符号表示
用元素符号表示![]() 。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______
。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______ ![]() 写化学式
写化学式![]() 。
。
(3)D可形成化合物![]() 。
。
![]() 中配位体的VSEPR模型名称是_____________。该化合物中阴离子的中心原子的轨道杂化类型为_____________。
中配位体的VSEPR模型名称是_____________。该化合物中阴离子的中心原子的轨道杂化类型为_____________。
![]() 个
个![]() 中含有的
中含有的![]() 键数目为______个。
键数目为______个。
(4)已知B、C两种元素形成的化合物通常有两种。这两种化合物中_____________![]() 填化学式
填化学式![]() 为非极性分子,另一种化合物的电子式为_____________。
为非极性分子,另一种化合物的电子式为_____________。
(5)![]() 离子能与
离子能与![]() 离子形成ESCN沉淀。
离子形成ESCN沉淀。![]() 离子对应的酸有硫氰酸
离子对应的酸有硫氰酸![]() 和异硫氰酸
和异硫氰酸![]() ,这两种酸沸点更高的是______(填名称),原因是__________。
,这两种酸沸点更高的是______(填名称),原因是__________。
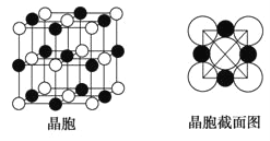
(6)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如图所示为A、C形成化合物的晶胞结构图以及晶胞的截面图,晶胞中距离一个![]() 最近的
最近的![]() 有______个,距离一个
有______个,距离一个![]() 最近的
最近的![]() 围成的图形是_____________
围成的图形是_____________![]() 写名称
写名称![]() 。若晶体密度为
。若晶体密度为![]()
![]() ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用![]() 表示,则
表示,则![]() 的半径为____________________
的半径为____________________![]() 用含
用含![]() 与
与![]() 的式子表达
的式子表达![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 1 mol Fe溶于过量硝酸,电子转移数为2NA
B. 2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
C. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
D. 0.1 mol 的11B中,含有0.6NA个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机分子中,所有的原子不可能处于同一平面的是( )
A. CH2==CH2 B. CH2==CH—CH==CH2
C. CH2==C(CH3)—CH==CH2 D. CH2==CH—C≡CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq) + 2I-(aq) + 2H+(aq) I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
反应ii:I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
(1)H2O2与S2O32-反应的热化学方程式为______。
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均为0.01 mol/L)。
a.向酸化的H2O2溶液中加入________溶液,溶液几秒后变为蓝色。
b._________,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为0.01 mol/L)
实验序号 | a | b | |
试 剂 | H2O2/mL | 5 | ______ |
H2SO4/mL | 4 | 2 | |
Na2S2O3/mL | 8 | _____ | |
KI(含淀粉)/mL | 3 | _____ | |
H2O | 0 | ______ | |
将上述溶液迅速混合 观察现象 | 溶液变蓝所需时间 为t1秒 | 溶液变蓝所需时间 为t2秒 | |
① 将实验b补充完整。
② 对比实验a和实验b,t1_____t2(填“>”或“<”)。
③ 结合(2)中现象解释溶液混合后一段时间才变蓝的原因________。
④ 利用实验a的数据,计算t1时间内H2O2与S2O32-反应的平均反应速率(用H2O2浓度的变化表示)________mol/(L·s)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图3-4-2所示。下列说法错误的是( )
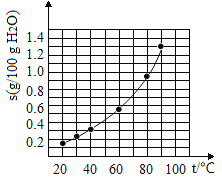
A. 溴酸银的溶解是放热过程
B. 温度升高时溴酸银的溶解速率加快
C. 60℃时溴酸银的Ksp约等于6×10-4
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com