
【题目】下列指定反应的离子方程式正确的是( )
A.醋酸溶解水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
B.向氨水中通入过量SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
C.用石墨作电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓
【答案】D
【解析】
A.碳酸钙和醋酸都需要保留化学式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO,故A错误;
B.向氨水中通入过量SO2,反应生成亚硫酸氢铵,正确的离子方程式为:NH3·H2O+SO2═NH4++HSO3,故B错误;
C.因电解时在阴极附近产生了大量OH-,OH-能与Mg2+反应:Mg2++2OH-=Mg(OH)2↓,离子反应:Mg2++2Cl-+2H2O![]() Cl2↑+H2↑+Mg(OH)2↓,故C错误;
Cl2↑+H2↑+Mg(OH)2↓,故C错误;
D.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合恰好全部转化为沉淀,离子反应为:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】乙醇燃料电池中采用磺酸类质子溶剂,在200 ℃左右时供电,电池总反应式为C2H5OH+3O2=2CO2+3H2O,电池示意图如下,下列说法中正确的是( )

A.电池工作时,质子向电池的负极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a极上发生的电极反应是C2H5OH+3H2O+12e-=2CO2+12H+
D.b极上发生的电极反应是2H2O+O2+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A. ①中还需要进行过滤操作,滤渣为二氧化硅
B. a、b中铝元素的存在形式不同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇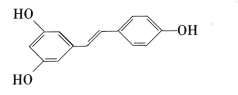 广泛存在于食物(如桑葚、花生,尤其是葡萄)中,它具有抗癌性。请回答下列问题。
广泛存在于食物(如桑葚、花生,尤其是葡萄)中,它具有抗癌性。请回答下列问题。
(1)白藜芦醇的分子式为_____,所含官能团的名称为_____;
(2)下列关于白藜芦醇的说法正确的是_____
A.可使酸性KMnO4溶液褪色
B.可与FeCl3溶液反应显紫色
C.可使溴的CCl4溶液褪色
D.可与NH4HCO3溶液反应产生气泡
E.属于醇类
F.不能发生酯化反应
(3)1mol该有机物最多能消耗____molNaOH,最多能消耗_____molBr2;
(4)1mol该有机物与H2加成时,最多消耗标准状况下的H2的体积为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,图甲表示反应速率(v)与温度(T)的关系、图乙表示T1时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法不正确的是( )
2SO3(g)ΔH<0,图甲表示反应速率(v)与温度(T)的关系、图乙表示T1时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法不正确的是( )
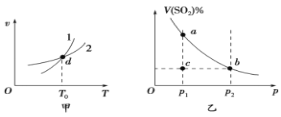
A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点时,混合气体的平均摩尔质量不再改变
C.图乙中,a、b两点的反应速率:va>vb
D.图乙中,c点的正、逆反应速率:v(逆)>v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:2A(g)+B(g)![]() xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
A. x=3 B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是__。
SO2压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2molSO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
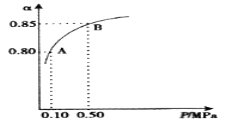
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。平衡状态由A变到B时,平衡常数K(A)__K(B)(填“>”、“<”或“=”),B点的化学平衡常数是__。
(4)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,t1时刻达到平衡,测得容器中含SO30.18mol。
①tl时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是__。
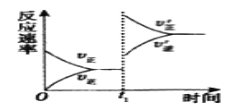
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20molSO2和0.10molO2,则平衡__移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,_mol<n(SO3)<_mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的名称:
A.(CH3)3CCH(CH3)(CH2)2CH(C2H5)2 A的名称是________;
B.(CH3)3CC≡CCH2CH3 B的名称是____;
C.![]() C的名称是_____
C的名称是_____
D.CH2OHCH(C2H5) CH2OH D的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中由水电离出的c(H+)=1×10-11mol/L,该溶液不可能是( )
A. 硫酸氢钠溶液 B. 醋酸钠溶液 C. 氢氧化钠溶液 D. 二氧化硫水溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com