
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1 r溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如下图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1 r溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如下图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>Y>X | ||
| C. | W、X形成的1:1型的化合物有很多种 | D. | X的最高价氧化物的水化物为强酸 |
分析 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,则n为Cl2,Z为Cl;氯气与p在光照条件下生成r与s,0.01mol•L-1r溶液的pH为2,则r为HCl,s通常是难溶于水的液态混合物,则s为氯代烃的混合物、p为CH4等烷烃,氯气与m反应生成HCl与q,q的水溶液具有漂白性,则m为H2O,q为HClO,结合原子序数可知W为H元素,X为C元素,Y为O元素,结合元素周期律解答.
解答 解:短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,则n为Cl2,Z为Cl;氯气与p在光照条件下生成r与s,0.01mol•L-1r溶液的pH为2,则r为HCl,s通常是难溶于水的液态混合物,则s为氯代烃的混合物、p为CH4等烷烃,氯气与m反应生成HCl与q,q的水溶液具有漂白性,则m为H2O,q为HClO,结合原子序数可知W为H元素,X为C元素,Y为O元素,
A.H原子半径最小,同周期自左而右原子半径减小,故原子半径W(H)<Y(O)<X(C),故A错误;
B.氯的氧化物中氧元素表现负化合价,氧元素非金属性比氯的强,高氯酸为强酸,碳酸为弱酸,氯元素非金属性比碳的强,故非金属性Y(O)>Z(Cl)>X(C),故B错误;
C.W、X分别为H、C元素,C、H形成的1:1型的化合物有C2H2、C6H6、C8H8等多种,故C正确;
D.X的最高价氧化物的水化物为碳酸,碳酸属于弱酸,故D错误;
故选C.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应、元素周期律等为解答的关键,侧重分析与推断能力的考查,注意n为氯气及氯气性质为推断的突破口,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:实验题
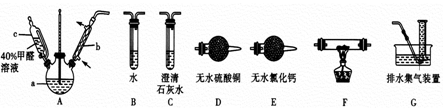

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等.以下是屈昔多巴的一种合成路线(通常
)可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等.以下是屈昔多巴的一种合成路线(通常 简写为BnCl,
简写为BnCl, 简写为CbzCl ):
简写为CbzCl ):
 显碱性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:
显碱性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:
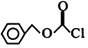 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有6种,其中核磁共振氢谱为四组峰的结构简式为
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有6种,其中核磁共振氢谱为四组峰的结构简式为 (任写一种).
(任写一种). .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 两个容积均为2L 的密闭容器I和Ⅱ中发生反应2NO(g)+2CO(g)?N2(g)+2CO(g),起始物质的量见表.
两个容积均为2L 的密闭容器I和Ⅱ中发生反应2NO(g)+2CO(g)?N2(g)+2CO(g),起始物质的量见表.| 容器 | 起始物质的量 | |
| NO | CO | |
| Ⅰ | 1mol | 3mol |
| Ⅱ | 6mol | 2mol |
| A. | N点的平衡常数为0.04L/mol | |
| B. | M、N两点容器内的压强:P(M)>2P(N) | |
| C. | 若将容器I的容积改为1L,T1温度下达到平衡时c(CO2)=0.25mol/L | |
| D. | 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率大于16.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5s的平均速率v(B)=0.015mol/(L•s) | |
| B. | 保持其他条件不变,升高温度,平衡时c(A)=0.41mol/L,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的转化率大于80% | |
| D. | 相同温度下,起始时向容器中充入0.20molA、0.20molB和1.0molC,反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 氨盐受热易分解,因此贮存氨态氮肥时要密封保存,不需放在阴凉通风处 | |
| D. | 稀HNO3和活泼金属反应时主要得到氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com