
【题目】已知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为 ,该反应的Q 0。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反 应速率v(CO)= 。

(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020mol/L,该条件下,CO的最大转化率为 。
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x平衡时CO的转化率为y,试推导y随x变化的函数关系式为 。
(5)某电化学装置可实现2CO2=2CO+O2的转化,使CO重复使用。已知该反应的阳极应为4OH--4e-=2H2O+O2,则阴极反应式为 。
(6)有人提出可以设计反应2CO=2C+O2(ΔH>0)来消除CO的污染,请判断上述反应能否发生 (填“可能”或“不可能”),理由是 。
【答案】(1)K=![]() <
<
(2)0.03 mol/(L·min)
(3)75%
(4)y=x
(5)CO2+2e-+H2O=CO+2OH-
(6)不可能;ΔH>0吸热且ΔS<0 或依据吉布斯自由能判断反应不能自发进行
【解析】(1)根据平衡常数的定义可得K=![]() ,随温度升高,平衡常数减小,说明升温平衡向逆移动,正反应是放热反应,Q <0。
,随温度升高,平衡常数减小,说明升温平衡向逆移动,正反应是放热反应,Q <0。
(2)0—4min时,CO的浓度减少0.12mol/L,所以v(CO)=0.03 mol/(L·min) 。
(3)500 ℃时,K=9,设CO的浓度减少xmol/L,则有9(0.02-x)2=x2,x=0.015mol/L,该条件下,CO最大的转化率为75%。
(4))850 ℃时,K=1,起始时CO和H2O共为1mol,其中水蒸气的体积分数是x,所以H2O(g)的物质的是为xmol,CO的物质的量为(1-x)mol,设平衡时CO转化了amol,则a2=(x-a)(1-x-a),解得a=x-x2,CO的转化率为(x-x2)/(1-x)=x;
(5)总的是2CO2=2CO+O2,阳极反应为4OH—4e-=2H2O+O2,则总反应减去阳极得到阴极反应式为,CO2+2e-+H2O=CO+2OH- 。
(6)不可能,因为该反应属于熵减焓增的反应,不能自发进行。


科目:高中化学 来源: 题型:
【题目】下列反应中,生成物的总焓大于反应物总焓的是
A. 氢气在氧气中燃烧 B. 铁丝在氧气中燃烧
C. 硫在氧气中燃烧 D. 焦炭在高温下与水蒸气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫外光照射时,在不同催化剂作用下,可将CO2和H2O(g)转化为CH4和O2,CH4产量随光照时间的变化见图1。以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图2。下列有关说法中正确的是( )
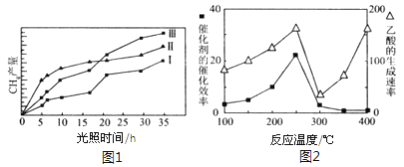
A. 由图1知,在0~15 h内,CH4的平均生成速率从大到小的顺序:Ⅲ>Ⅱ>Ⅰ
B. 由图1知,在0~35 h内,CH4的平均生成速率从大到小的顺序:Ⅱ>Ⅲ>Ⅰ
C. 由图2知,250 ℃时催化剂的活性最高
D. 由图2知,乙酸的生成最佳温度范围: 400 ℃以上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖
其中属于电解质的是___________ ,属于强电解质的是_____________。能导电的是___________。
Ⅱ.胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入___________溶液,继续煮沸至____________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为______________________________________________。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做_______________。
③区分胶体和溶液常用的方法叫做__________。
Ⅲ.①FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为_________________________。
②有学生利用FeCl3溶液制取FeCl36H2O晶体主要操作包括:滴入过量盐酸,______、冷却结晶、过滤。过滤操作除了漏斗、烧杯还需要什么玻璃仪器________________。
③高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是( )

A. a=6.00
B. 同时改变反应温度和蔗糖的浓度,v可能不变
C. b<318.2
D. 不同温度时,蔗糖浓度减少一半所需的时间相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x和y的关系如图所示。计算:
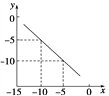
(1)该温度下水的离子积为___________
(2)该温度下,0.01 mol/L的NaOH溶液的pH为___________
Ⅱ.已知25 ℃时,Ka(CH3COOH)=1.6×10-5。
(1)向0.1 mol·L-1醋酸溶液中加入一定量1 mol·L-1盐酸时,上式中的数值是否发生变化________(填是或否)解释原因______________________
(2)若醋酸的起始浓度为0.010 mol·L-1,平衡时c(H+)=______________
Ⅲ. 已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=6.25×10-5mol·L-1。
若忽略水的电离及H2CO3的第二级电离,则H2CO3 ![]() HCO
HCO![]() +H+的平衡常数K1=________。(已知10-5.60=2.5×10-6)
+H+的平衡常数K1=________。(已知10-5.60=2.5×10-6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向AgCl饱和溶液中加水,下列叙述正确的是
A.AgCl的溶解度减小B.AgCl的溶解度增大,Ksp不变
C.c(Ag+)增大D.AgCl的溶解度、Ksp均不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com