
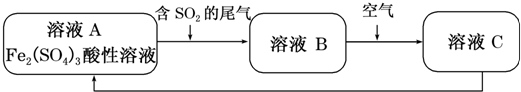
| A. | 向C溶液中滴加KSCN溶液,溶液变为血红色 | |
| B. | 溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亚铁可以使溶液C转化为溶液A |
分析 A.尾气中的二氧化硫气体,通入酸性硫酸铁溶液中发生氧化还原反应,三价铁离子氧化二氧化硫为硫酸,本身被还原,B溶液含有二价铁离子,二价铁离子与KSCN溶液不反应;
B.根据氧化性O2>Fe3+角度进行分析解答,该离子方程式左右电荷不守恒;
C.溶液A为Fe2(SO4)3溶液中三价铁离子水解显酸性,溶液B为硫酸溶液,显酸性,溶液C为硫酸铁溶液和硫酸溶液,据此分析解答;
D.溶液C为硫酸铁溶液和硫酸溶液,加氧化亚铁可以使硫酸转化为硫酸亚铁.
解答 解:A.尾气中的二氧化硫气体,通入酸性硫酸铁溶液中发生2Fe3++2H2O+SO2=2Fe2++SO42-+4H+,B溶液中存在二价铁离子,二价铁离子与KSCN溶液不反应,溶液不会变为血红色,B溶液通入空气会氧化亚铁离子,得到C溶液中有铁离子,向C溶液中滴加KSCN溶液,溶液变为血红色,故A正确;
B.溶液B中发生的反应是亚铁离子被氧气氧化为三价铁离子的反应:4Fe2++O2+4H+=4Fe3++2H2O,故B错误;
C.反应过程中溶液的体积不变,溶液A为Fe2(SO4)3溶液中三价铁离子水解显酸性,溶液B为被二氧化硫还原生成的硫酸亚铁和二氧化硫被氧化生成的硫酸溶液,显酸性,溶液C为硫酸铁溶液和硫酸溶液,是发生反应4Fe2++O2+4H+=4Fe3++2H2O的结果,虽然消耗氢离子但溶液呈酸性,B>C>A,故C错误;
D.溶液C为硫酸铁溶液和硫酸溶液,加氧化亚铁,氧化亚铁和硫酸反应生成硫酸亚铁、水,溶液C为硫酸铁溶液和硫酸亚铁溶液,故D错误;
故选A.
点评 本题考查了污染气体二氧化硫的综合处理工艺流程的分析判断,为高频考点,侧重于学生的分析能力的考查,题目涉及氧化还原反应的规律应用,主要是考查二氧化硫的还原性、三价铁离子的氧化性、二价铁离子的还原性的性质应用,注意反应的产物判断是本题的关键,题目难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| B. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA | |
| D. | 14g乙烯和丙烯混合气体中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
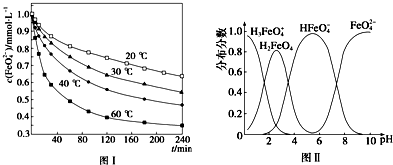
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
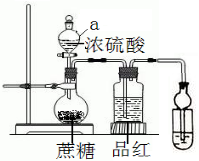 在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答:
在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
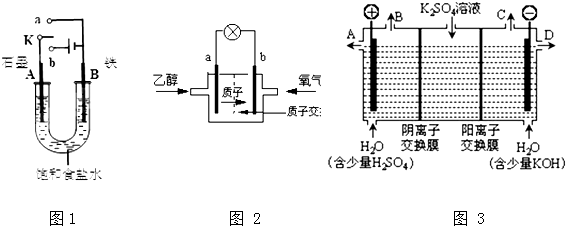
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.4 mol/L HB溶液和 0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 等浓度的下列稀溶液:①硫酸氢钠 ②乙酸钠 ③醋酸 ④碳酸氢钠 ⑤硝酸钠 ⑥苯酚钠,它们的pH由小到大排列为:③⑤①④②⑥ | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 在25℃时,将a mol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
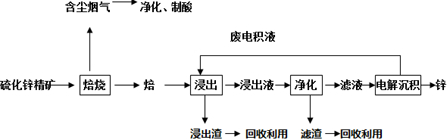
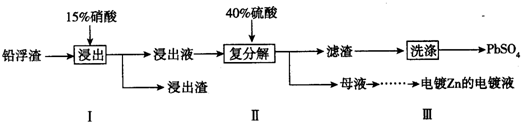
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com