
分析 (1)盐酸溶液中c(H+)=c(HCl),c(OH-)=$\frac{Kw}{c({H}^{+})}$,pH=-lgc(H+),据此分析解答;
(2)pH=13的Ba(OH)2溶液中氢离子浓度c(H+)=10-13mol/L,c(OH-)=$\frac{Kw}{c({H}^{+})}$,Ba(OH)2溶液的物质的量浓度c=$\frac{c(O{H}^{-})}{2}$;
(3)稀释过程中溶质的物质的量不变,据此计算出稀释后氢离子浓度,再根据pH=-lgc(H+)计算出稀释后溶液的pH;
(4)pH=2H2SO4和pH=13NaOH恰好完全中和,说明氢离子物质的量等于氢氧根离子物质的量,据此计算;
解答 解:(1)氯化氢是强电解质,在水中完全电离,所以盐酸溶液中c(H+)=c(HCl)=0.01mol/L,c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,pH=-lgc(H+)=-lg0.01=2,
故答案为:0.01;10-12;2;
(2)pH=13的Ba(OH)2溶液中氢离子浓度c(H+)=10-13mol/L,c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L,Ba(OH)2溶液的物质的量浓度c=$\frac{c(O{H}^{-})}{2}$=0.05mol/L,
故答案为:0.05;
(3)pH=3的HCl溶液中氢离子浓度为0.001mol/L,将溶液稀释到原来103倍后,溶液中氢离子浓度为:0.001mol/L×10-3=1×10-6mol/L,稀释后溶液的pH=-lgc(H+)=46,
故答案为:6;
(4)pH=2的H2SO4和pH=13的NaOH恰好完全中和,设硫酸溶液体积为V(酸),氢氧化钠溶液体积为V(碱),氢离子物质的量等于氢氧根离子物质的量,得到计算关系:10-2mol/L×V(酸)=$\frac{1{0}^{-14}}{1{0}^{-13}}$×V(碱)则硫酸与氢氧化钠应按体积比=V(酸):V(碱)=10:1,
故答案为:10:1;
点评 本题考查了溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系方法为解答关键,注意掌握溶液pH的概念及计算方法,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下NA个CH3CH2OH分子的体积约为22.4L | |
| B. | 1molCl2参加化学反应,转移的电子数一定为2NA | |
| C. | 23g14CO2与NO2的混合气体中,含O原子数、电子数分别为NA、11.5NA | |
| D. | 将标准状况下22.4L HCl气体通入1L、1mol/L的CH3COONa溶液,所得溶液中CH3COOH分子与CH3COO-离子的总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 个 | B. | 3 个 | C. | 4 个 | D. | 5 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定含有溴化氢,不一定含有二氧化碳 | |
| B. | 一定不含二氧化碳 | |
| C. | 一定不含氨气和硫化氢 | |
| D. | 可能含有二氧化碳和氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.43mol | B. | 2mol | C. | 0.8mol | D. | 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.98g | B. | 2.00g | C. | 2.22g | D. | 2.42g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W1>W2>W3 | B. | W1=W2=W3 | C. | W3>W1>W2 | D. | W3>W2>W1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水中含有的水分子数为NA | |
| B. | 1mol Fe与足量的盐酸反应电子转移总数为3NA | |
| C. | 常温常压下,22g CO2中含有的氧原子数为NA | |
| D. | 500mL 1mol/L MgCl2溶液中含有Cl-数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
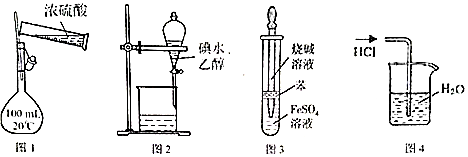
| A. | 用图1装置配制100 mL 0.1mol•L-1硫酸 | |
| B. | 用图2所示装置可萃取碘水中的碘 | |
| C. | 用图3所示装置可制备氢氧化亚铁 | |
| D. | 用图4所示装置可吸收HCl气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com