
【题目】随着学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点.完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如表:
[CO2]/molL﹣1 | [H2]/molL﹣1 | [CH4]/molL﹣1 | [H2O]/molL﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为 .
(3)碳酸:H2CO3 , Ki1=4.3×10﹣7 , Ki2=5.6×10﹣11
草酸:H2C2O4 , Ki1=5.9×10﹣2 , Ki2=6.4×10﹣5 0.1mol/L Na2CO3溶液的pH0.1mol/L Na2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是 .
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是 . (选填编号)
a.[H+]>[HC2O4﹣]>[HCO3﹣]>[CO32﹣]b.[HCO3﹣]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣]
c.[H+]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣]d.[H2CO3]>[HCO3﹣]>[HC2O4﹣]>[CO32﹣].
【答案】
(1)增大;增大;减小;减小
(2)![]() =
= ![]()
![]()
(3)>;草酸;ac
【解析】解:(1)H2的体积分数随温度的升高而增加,这说明升高温度平衡逆反应方向进行,即正反应是放热反应;升高温度正、逆反应速率均增大,平衡逆反应方向进行,平衡常数减小,反应物的转化率减小,
所以答案是:
v正 | v逆 | 平衡常数K | 转化率α |
增大 | 增大 | 减小 | 减小 |
(2)相同温度时平衡常数不变,则a、b、c、d与m、n、x、y之间的关系式为 ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() =
= ![]() ;(3)根据电离常数可知草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠,所以0.1 mol/L Na2CO3溶液的pH大于0.1 mol/L Na2C2O4溶液的pH,
;(3)根据电离常数可知草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠,所以0.1 mol/L Na2CO3溶液的pH大于0.1 mol/L Na2C2O4溶液的pH,
草酸的酸性强于碳酸,则等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸,
草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中[H+]>[HC2O4﹣]>[C2O42﹣]>[HCO3﹣]>[CO32﹣],则ac正确,bd错误.
所以答案是:>;草酸;ac.
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%),还要掌握弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理)的相关知识才是答题的关键.


科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2﹣和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是 .
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是 .
(3)X与Z中电负性较大的是 . Z的某种含氧酸盐常用于实验室中X的单质的制取,此酸根离子的空间构型是 , 此离子中含有的化学键类型是 , X﹣Z﹣X的键角109.5°.(填“>”“=”或“<”)(提示:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力).
(4)X与Y形成的化合物Y2X的晶胞如图.其中X离子的配位数为 , 以相距一个X离子最近的所有Y离子为顶点构成的几何体为 . 该化合物与MgO相比,熔点较高的是 . 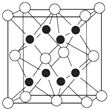
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为gcm﹣3 . (只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.上述电池工作时,有关说法正确的是( ) 
A.铝罐将逐渐被腐蚀
B.碳粒和炭棒上发生的反应为:O2+4e﹣=2O2﹣
C.炭棒应与玩具电机的负极相连
D.该电池工作一段时间后炭棒和炭粒的质量会减轻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油画所用颜料含有某种白色铅化物,此颜料置于空气中长时间后就会变成黑色PbS,从而使油画的色彩变暗,若用双氧水H2O2来清洗,则可将PbS变成PbSO4,从而使油画复原。上述清洗反应的化学方程式为 PbS+ 4H2O2 = PbSO4 + 4M(已配平)
(1)生成物M的化学式为_________________________
(2)在此反应中,PbS作 _____________剂,H2O2作 _____________剂
(3)若发生转移的电子数目2mol时,参加反应的H2O2的质量为 ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行下列化学基本量的计算,并将结果直接填入空格中。二氧化碳的摩尔质量是 _________,9g水的物质的量是________,0.5molO2在标准状况下的体积约为_______________,约含有___________个氧原子。(NA表示阿伏加德罗常数的值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 氧化还原反应中氧化剂失电子总数等于还原剂得电子总数
B. 电解质不一定导电,导电的物质不一定是电解质
C. 任何化学反一定都遵循质量守恒,是离子反应的还要遵循电荷守恒
D. 离子方程式不仅可以表示一个具体的反应,而且可以表示所有同一类型的离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X(g)+Y(g)2Z(g);正反应放热.从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2→t3的曲线变化是由哪种条件引起的( ) 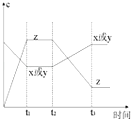
A.增大X或Y的浓度
B.增大压强
C.增大Z的浓度
D.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com