
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 中和热测定实验中,若用铜质搅拌器,则所测中和热的绝对值偏大 | |
| C. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 | |
| D. | 蛋白质属于天然高分子化合物,盐酸可以使蛋白质变黄,称为颜色反应 |
分析 A.淀粉与纤维素的分子式均为(C6H10O5)n,n不同;
B.若用铜质搅拌器,Cu导热,则热量散失;
C.油脂为高级脂肪酸甘油酯,含-COOC-;
D.蛋白质的相对分子质量在10000以上,含苯环的蛋白质遇浓硝酸变为黄色.
解答 解:A.淀粉与纤维素的分子式均为(C6H10O5)n,n不同,二者不是同分异构体,故A错误;
B.若用铜质搅拌器,Cu导热,则热量散失,所测中和热的绝对值偏小,故B错误;
C.油脂为高级脂肪酸甘油酯,含-COOC-,在碱性条件下的水解,可以制甘油和肥皂,故C正确;
D.蛋白质的相对分子质量在10000以上,含苯环的蛋白质遇浓硝酸变为黄色,为颜色反应,蛋白质与盐酸发生变性,故D错误;
故选C.
点评 本题考查化学实验评价,为高频考点,把握中和热测定、有机物的结构与性质为解答本题的关键,侧重分析与实验能力的考查,注意蛋白质的性质,题目难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
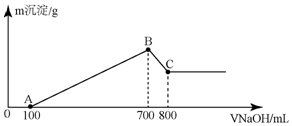 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白:
将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18g${\;}_{\;}^{18}$O2中含有NA个氧分子 | |
| B. | 标准状况下,22.4L空气含有NA个单质分子 | |
| C. | 1 molCI2参加反应转移电子数可能为1NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的实验装置如下:实验中可能用到的数据如表:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的实验装置如下:实验中可能用到的数据如表:| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素在不同化合物中的化合价均不同 | |
| B. | 金属一定具有良好的导电性、导热性和延展性 | |
| C. | 金属单质在化学反应中化合价一定升高,作还原剂 | |
| D. | 常温下,所有金属都能与酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烃和卤代烃都不溶于水,且密度比水小 | |
| B. | 沸点由高到低顺序为CH3CH2CH2Br>CH3CH2Br>CH3CH2Cl>CH3CH3 | |
| C. | CH3Cl、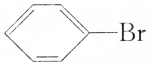 、CH3CH2Br都能发生水解反应和消去反应 、CH3CH2Br都能发生水解反应和消去反应 | |
| D. | CH3CH2I与酸化的AgNO3溶液反应会产生黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com