
分析 A元素的原子是半径最小的原子,则A为H元素;B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,则B为N元素,则X为NH4NO3;D与A同主族,D的原子序数大于N,则D为Na;D且与E同周期,则E为第三周期元素,其次外层电子数为8,最外层电子数为$\frac{3}{4}$×8=6,即E为S元素,能与H、N、Na、S形成元素的原子个数比不相同的若干化合物,结合原子序数可知元素C应为O元素,据此解答.
解答 解:(1)硫元素有三个电子层,最外层6个电子,所以是第3周期,第ⅥA族;X为NH4NO3,中存在离子键、共价键,故答案为:第3周期,第ⅥA族;离子键、共价键;
(2)电子层数越多半径越大,电子层数相同核电荷数越多半径越小,所以半径大小为:S2->O2->Na+;非金属性越强氢化物越稳定,所以稳定性:H2O>H2S,故答案为:S2->O2->Na+;H2O>H2S;
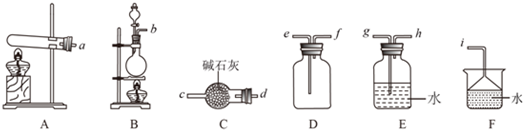
(3)①B元素的氢化物分子式是NH3,氢化物的电子式为: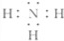 ,其实验室发生装置可以选择如图中的A实验室制取,反应的化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
,其实验室发生装置可以选择如图中的A实验室制取,反应的化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为: ;A;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
;A;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②欲制备并收集一瓶干燥的该气体,根据氨气是碱性气体,选用C装置干燥,氨气的密度小于水用向上排空气法,氨气的尾气除理用水吸收,所以其连接顺序为:a→d→c→f→e→i,故答案为:a→d→c→f→e→i;
③铵根离子的检验方法是取少量X溶液于试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝色,则阳离子为NH4+,故答案为:取少量X溶液于试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝色,则阳离子为NH4+;
(4)E的最高价态与A、B、C三种元素形成的酸式盐Y是NH4HSO4,电离方程式为:NH4HSO4=NH4++H++SO42-,故答案为:NH4HSO4=NH4++H++SO42-.
点评 本题考查结构与性质、位置关系,题目难度不大,正确推断元素的种类为解答该题的关键,注意电子式的书写,实验操作.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铝合金制作门窗 | B. | 用铝合金制作飞机材料 | ||
| C. | 用金属铝制盛装碳酸饮料的易拉罐 | D. | 用金属铝制作电线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);
(1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):用NaOH溶液洗涤后分液 | |
| B. | 乙烷(乙烯):用溴水洗气 | |
| C. | 溴苯(溴):用NaOH溶液洗涤后分液 | |
| D. | 乙醇(水):用生石灰吸水后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>HClO4 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com