
| KW |
| C(H+) |
| 10-2+10-4 |
| 2 |
| 10-14 |
| 5.05��10-3 |


 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Һ��ʯ��������Ȼ������Ҫ�ɷֶ��Ǽ��� |
| B�������Ҵ������ᶼ�ܷ���ȡ����Ӧ |
| C����֬�ڼ�Ĵ������¿ɷ���ˮ�⣬��ҵ�����ø÷�Ӧ�������� |
| D��ú�ĸ�����Եõ������ױ��ȷ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �Ȼ�ѧ����ʽ | ��H��С�Ƚ� | |||
| A | S��g��+O2��g��=SO2��g����H1 | ��H1����H2 | ||
| S��s��+O2��g��=SO2��g����H2 | ||||
| B | 2H2��g��+O2��g��=2H2O��1����H1 | ��H1����H2 | ||
| 2H2��g��+O2��g��=2H2O��g����H2 | ||||
| C | CH3COOH��aq��+NaOH��aq��=CH3COOHNa��aq��+H2O��1����H1 | ��H1����H2 | ||
| HCl��aq��+NaOH��aq��=NaCl��aq��+H2O��1����H2 | ||||
| D | 2Na��s��+
| ��H1����H2 | ||
| 2Na��s��+O2��g��=Na2O2 ��H2 |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ͨ���������������Һ�� Cl2+2OH-�TCl-+ClO-+H2O |
| B��AlCl3��Һ�м��������İ�ˮ��Al3++3OH-�TAl��OH��3�� |
| C�����Ȼ�����Һ�м������ۣ�Fe3++Fe=2Fe2+ |
| D����Ƭ������������Һ��Ӧ Al+2OH-=AlO2-+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ˮ���ȣ�ƽ��������Ӧ�����ƶ���KW���� |
| B����ˮ�м����������ᣬƽ��������Ӧ�����ƶ���c��H+������ |
| C����ˮ�м�������NaOH���壬ƽ�����淴Ӧ�����ƶ���c��OH-������ |
| D����ˮ�м�����CH3COONa���壬ƽ��������Ӧ�����ƶ���ˮ�����c��OH-���� c��H+����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
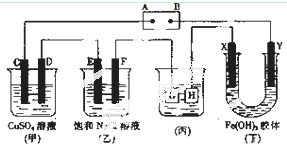 ��ͼ��ʾ��װ�ã�C��D��E��F��X��Y���Ƕ��Ե缫������Դ��ͨ�������е����̪Һ����F�������Ժ�ɫ��
��ͼ��ʾ��װ�ã�C��D��E��F��X��Y���Ƕ��Ե缫������Դ��ͨ�������е����̪Һ����F�������Ժ�ɫ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A | B | C | D | |
| ������� | HBr | CH3COOH | HF | Ca��OH��2 |
| ǿ����� | H3PO4 | FeCl3 | BaSO4 | HI |
| �ǵ���� | CCl4 | Cu | C2H5OH | H2O |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com