
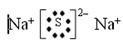
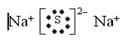 ;(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 SO2+Cl2+2H2O=H2SO4+2HCl ;(4)Y、Z气态氢化物的稳定性为HCl>H2S;(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是S2->Cl->Na+>Al3+;(6)Z的最高价氧化物为Cl2O7,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量,即一摩尔为放出4QkJ的能量,所以该反应的热化学方程式为Cl2O7(l)+H2O(l)= 2HClO4(aq);ΔH="-4Q" kJ·mol-1。
;(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 SO2+Cl2+2H2O=H2SO4+2HCl ;(4)Y、Z气态氢化物的稳定性为HCl>H2S;(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是S2->Cl->Na+>Al3+;(6)Z的最高价氧化物为Cl2O7,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量,即一摩尔为放出4QkJ的能量,所以该反应的热化学方程式为Cl2O7(l)+H2O(l)= 2HClO4(aq);ΔH="-4Q" kJ·mol-1。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源:不详 题型:填空题
 Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热稳定性:H2O>HF>H2S | B.原子半径:Na>Mg>O |
| C.酸性:H3PO4>H2SO4>HClO4 | D.金属性:Na>Mg>Ca |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫 | B.砷 | C.硒 | D.硅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.气态氢化物的稳定性甲比乙弱 | B.最高价氧化物的水化物的酸性甲比乙强 |
| C.阴离子的还原性甲比乙弱 | D.金属性甲比乙弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该元素原子处于能量最低状态时,原子中共有3个未成对电子 |
| B.该元素原子核外共有5个电子层 |
| C.该元素原子的M能层共有8个电子 |
| D.该元素原子最外层共有3个电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.“四中子”不显电性 |
| B.“四中子”的质量数为4,其质量比氢原子大 |
| C.第二种粒子是氧元素的另一种同位素 |
| D.第二种粒子的化学式为O4,与O2互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com