
【题目】某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下:
![]()
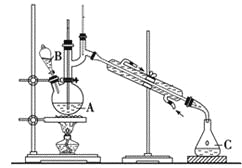
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是_____________________。
(2)加入沸石的作用是_________________。
(3)分液漏斗使用前必须进行的操作是__________________。
(4)反应温度应保持在90~95℃,其原因是___________________。
(5)本实验中,正丁醛的产率为___________________。
【答案】浓硫酸溶于水会放出大量热,容易溅出伤人 防止液体暴沸 检查是否漏水 将正丁醛及时分离出来,有利于正丁醛生成 51.4%
【解析】
(1)因为浓硫酸的密度大,溶于水放热,将Na2Cr2O7溶液加到浓硫酸中,容易发生迸溅。
(2)加入沸石的作用是防止暴沸。
(3)分液漏斗使用前必须进行的操作是检查是否漏水。
(4)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化。
(5)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式可知
C4H10O~C4H8O
74 72
4xg 2g
即74:72=4xg:2g
解得:x=51.4%。


科目:高中化学 来源: 题型:
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的简化电子排布式为 ________。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为_________。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为_______。
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为__________。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于___________________________。
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO] 的酸性由强到弱的顺序为_________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法或表述中不正确的是
A.等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,消耗的氧气乙烷最多
B.可借助于核磁共振氢谱区分乙醇和二甲醚这两种物质
C.CH3CH(CH3)CH(CH3)CH(C2H5)CH2CH3的名称:2,3-二甲基-4-乙基己烷
D.石油裂解和油脂的皂化都是高分子生成小分子的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
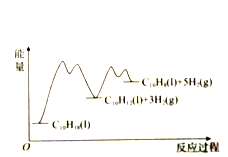
【题目】335℃时,在恒容密闭反应器中1.00mol![]() 催化脱氢的反应过程如下:
催化脱氢的反应过程如下:
反应1:![]()
反应2:![]()
测得![]() 和
和![]() 的产率
的产率![]() 和
和![]() (以物质的量分数计)随时间的变化关系及反应过程中能量的变化如图所示。下列说法错误的是( )
(以物质的量分数计)随时间的变化关系及反应过程中能量的变化如图所示。下列说法错误的是( )
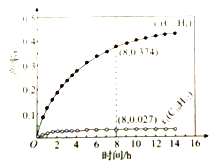
A. 使用催化剂能改变反应历程
B. 更换催化剂后![]() 、
、![]() 也会随之改变
也会随之改变
C. 8h时,反应1、2都未处于平衡状态
D. ![]() 显著低于
显著低于![]() ,是由于反应2的活化能比反应1的小,反应1生成的
,是由于反应2的活化能比反应1的小,反应1生成的![]() 很快转变成
很快转变成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态Fe2+核外电子排布式为___。
(2)在[Fe(CN)6]3-中不存在的化学键有__。
A.共价键 B.金属键 C.配位键 D.离子键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCl=HCN+KCl
HC≡CH+HCN→H2C=CH-C≡N
①KCNO中非金属元素原子的第一电离能由小到大排序为__。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是__;分子中σ键和π键数目之比为__。
(4)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

关于Fe(CO)5,下列说法正确的是__。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
(5)与C22-互为等电子体的微粒__(写出一种),CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为__。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为__nm(用含有d、NA的代数式表示)。
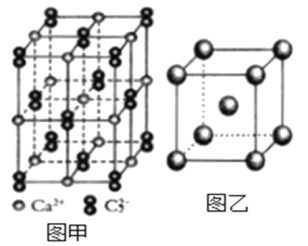
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图,下列说法不正确的是( )
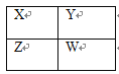
A.Y的气态氢化物的稳定性一定比W的强
B.W的原子序数可能是Y的原子序数的2倍
C.Y原子形成的简单离子半径一定比X原子形成的简单离子半径大
D.若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是实验室中常用于制备和干燥气体的装置:
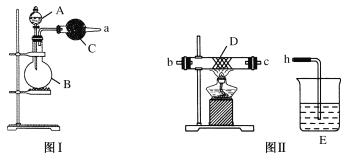
(1)甲同学用图Ⅰ装置、铜和稀硝酸制备并收集干燥的NO气体:
①B中反应的离子方程式为___;
②收集NO气体的方法为___。
(2)乙同学用图Ⅰ装置制取NH3和O2的混合气体,用图Ⅱ装置验证氨的某些性质:
往A中加入浓氨水,B中加入Na2O2固体,C中加入碱石灰,D内放置催化剂(铂石棉),按气流方向a→b→c→h连接各仪器:
①实验中观察到D内有红棕色气体出现,证明氨气具有___(填“氧化性”或“还原性”)。
②D中反应的化学方程式为___、___。
③为防止NO2污染环境,E装置中装的试剂可以是___。
(3)丙同学用图1、铜和浓硫酸制取SO2,则需要增加___(填仪器名称)。实验中他们取6.4g铜片和3mL8mol/L浓硫酸放在圆底烧瓶,反应结束后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:___。实验中若有mg铜参加了反应,转移电子的数目为___。
②实验结束后发现铜片未完全溶解但硫酸剩余的原因是___。
③下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是___(填字母)。
a.硫酸钠溶液 b.氯化钡溶液 c.银粉 d.碳酸氢钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.少量的二氧化碳气体通入足量烧碱溶液中反应CO2+OH-=HCO3-
C.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.向碳酸钙中滴加醋酸溶液:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com