
| A、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| B、常温下,42 g乙烯和环丙烷的混合气体中含有的碳原子数目为3NA |
| C、标准状况下,11.2 L氯仿(三氯甲烷)中含有C-Cl键的数目为1.5 NA |
| D、常温下,7.1gCl2与足量NaOH溶液作用,转移电子数目为0.2 NA |


科目:高中化学 来源: 题型:
| A、1mol铁与浓硝酸加热反应完全时转移电子数一定为3NA |
| B、2mol铝与足量烧碱溶液反应时被还原水的分子数为2NA |
| C、含NA个Na+的Na2O2与1L水完全反应后所得溶液中Na+的物质的量浓度为1mol/L |
| D、电解精炼铜,当外电路通过2NA个电子时,阳极溶解铜的物质的量小于1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA |
| B、常温常压下,15g甲基(-CH3)所含的中子数为6NA |
| C、在1L的碳酸钠溶液中,若c(CO32-)=1mol?L-1,则Na+个数为NA |
| D、含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(NO3)x中的x=2 |
| B、若反应中每0.2mol氧化剂被还原,则转移0.6mol电子 |
| C、稀HNO3在此反应中只表现氧化性 |
| D、磁性氧化铁中的铁元素全部被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、17g-OH与17g OH-所含电子数均为10Na |
| B、在0.lmol/L的碳酸钾溶液中,阴离子数目大于0.l NA |
| C、分子数为NA的NH3溶于水配成1L溶液,所得溶液中溶质的物质的量浓度为1mol/L |
| D、20mL l0mol/L的浓硝酸或浓硫酸与足量铜加热反应转移电子数均为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸与铁反应: 2Fe+6H+═2Fe3++3H2↑ |
| B、2 mol/L的AlCl3溶液和7 mol/L的Na0H溶液等体积均匀混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O |
| C、Ba(0H)溶液中加人少量的NaHS04溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| D、NaHC03 的水解:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
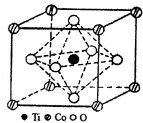 MnO2是碱锰电池材料中最普通的正极材料之一,在MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.| 元素 | Mn | Fe | |
| 电离能/kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若V1>V2,则说明HA的酸性比HB的酸性弱 |
| B、因为两种酸溶液的pH相等,故V1一定等于V2 |
| C、若V1>V2,则说明HA的酸性比HB的酸性强 |
| D、因为两种酸溶液的pH相等,所以HA与HB的酸性相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com