
| A. | K+、Na+、Cl-、SO42- | B. | NH4+、Na+、Cl-、HCO3- | ||
| C. | K+、Na+、NO3-、SO42- | D. | K+、Na+、OH-、SO42- |
分析 加入铝粉能放出H2的溶液,为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:加入铝粉能放出H2的溶液,为非氧化性酸或强碱溶液,
A.酸、碱溶液中该组离子之间均不反应,可大量共存,故A选;
B.碱性溶液中不能大量存在NH4+、HCO3-,酸性溶液中不能大量存在HCO3-,故B不选;
C.酸性溶液中好Al、H+、NO3-发生氧化还原反应不生成氢气,故C不选;
D.酸性溶液中H+、OH-结合生成水,不能大量共存,故C不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

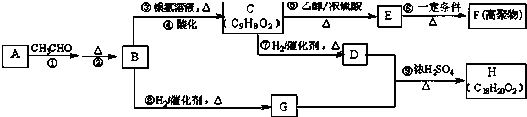
 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$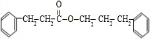 +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫通入已酸化的硝酸钡溶液 | |
| B. | 二氧化氮通入氯化亚铁溶液中 | |
| C. | 氢氧化铝沉淀中滴加氨水 | |
| D. | 过量铜片与稀硝酸反应结束的溶液中加入稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石、石英和足球烯均为空间网状结构的原子晶体 | |
| B. | 在NaOH、NH4Cl和Na2S04中,都存在离子键和共价键 | |
| C. | 干冰升华的过程只需克服分子间作用力 | |
| D. | H20分解生成H2和O2的过程中既有共价键断裂,又有共价键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次升高 | |
| C. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| D. | 2-甲基-1,3-丁二烯的键线式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
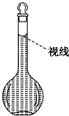 实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氢氧化钠固体放在滤纸上称量 | |
| B. | 用10 mL量筒量取8.58 mL蒸馏水 | |
| C. | 用强光照射鉴别淀粉胶体与碳酸钠两种无色液体 | |
| D. | 蒸馏时,应将温度计的水银球插入液面以下 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com