
【题目】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,相关信息如下:
元素 | 相关信息 |
X | 其单质为固体,常作电极材料 |
Y | 原子核外有6种不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(答题时,X、Y、Z、W、R、M用所对应的元素符号表示):
(1)X的单质与Z的单质反应的产物为_____________。(填化学式)。
(2)Z、W相比,第一电离能较大的是_____________,M2+的核外电子排布式为_____________。
(3)M2Z的熔点比M2W的_____________(填“高”或“低”),请解释原因______________________。
(4)Y和Z形成的化合物YZ2的VSEPR模型为__________,其中Y原子的杂化轨道类型为____________;N3-和YZ2互为等电子体,则N3-的结构式为_____________。
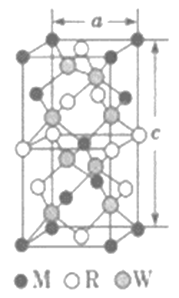
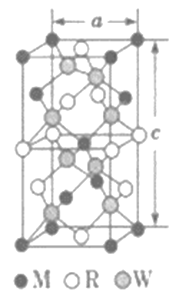
(5)MRW2的晶胞如图所示,晶胞参数a=0.524nm,c=1.032nm;MRW2的晶胞中每个M原子与_________个W原子相连,晶体密度ρ=________g·cm-3(只要求列算式,不必计算出数值,NA=6.02×1023mol-1)。
【答案】 Li2O O [Ar]3d9或1s22s22p63s23p63d9 高 O2-半径比S2-半径小,Cu2O比Cu2S的晶格能大,所以Cu2O的熔点高 直线形 sp杂化 [N=N=N]- 4 ![]()
【解析】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大。Y的原子核外有6个不同运动状态的电子,Y为C元素;X的单质为固体,常用作电极材料,X只能为Li元素;Z 是非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同,Z的电子排布式为1s22s22p4,为O元素;W是主族元素,与Zspan>原子的价电子数相同 ,W为S元素;R 的价层电子排布式为3d64s2,R为Fe元素;M位于第IB族,其被称作“电器工业的主角”,为Cu元素。
(1)锂与氧气反应生成氧化锂,故答案为:Li2O;
(2)同一主族,从上到下,第一电离能逐渐减小,O和S元素相比,第一电离能较大的是O,Cu2+的核外电子排布式为[Ar]3d9,故答案为:O;[Ar]3d9;
(3)氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高,故答案为:高;氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高;
(4)CO2中的C采用sp杂化,VSEPR 模型为直线型;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-,故答案为:直线型; sp;[N=N=N]-;
(5)由面心上Cu与2个S相连,晶胞中每个Cu原子与4个S相连;8个S均在体内,由化学式为CuFeS2,则含晶胞质量为![]() ,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=
,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=![]() =
=![]() =
=![]() gcm-3,故答案为:4;
gcm-3,故答案为:4;![]() 。
。
点睛:本题考查晶胞计算及杂化等,为高考常见题型和高频考点,侧重于学生的分析能力的考查,把握物质结构与性质、晶胞结构及计算等为解答该题的关键。本题的难点是晶胞的计算。
【题型】推断题
【结束】
12
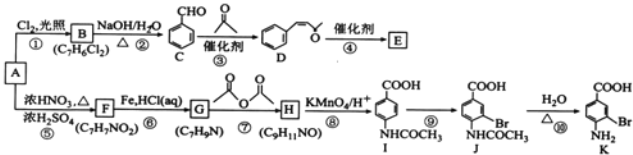
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如图所示:
已知: ;有机物分子中,同一个碳原子上连接有两个羟基时不稳定,会自动脱水。
;有机物分子中,同一个碳原子上连接有两个羟基时不稳定,会自动脱水。
回答下列问题:
(1)A的名称是_____________。K含有官能团的名称是__________________。
(2)反应⑦的作用是____________________________,⑩的反应类型是____________________________。
(3)写出反应②的化学方程式:____________________________________________________________。
(4)D分子中最多有_____________个原子共平面。E的结构简式为_____________。
(5)1molD与1molH2的加成产物同时满足下列条件的同分异构体有_____________种。
①苯环上只有四种不同化学环境的氢原子;
②能与FeCl3发生显色反应;
③分子中只存在一个环不含其它环状结构。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
 _________________________(无机试剂及溶剂任选)。合成路线流程图示例如下:CH3CHO
_________________________(无机试剂及溶剂任选)。合成路线流程图示例如下:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
【答案】 甲苯 羧基、氨基、溴原子 保护氨基 取代反应 ![]() +2NaOH
+2NaOH![]()
![]() +2NaCl+H2O 19
+2NaCl+H2O 19 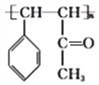 16
16 
【解析】分析:A属于芳香烃,A与Cl2光照发生侧链上取代反应生成B,B的分子式为C7H6Cl2,A的结构简式为![]() ,B的结构简式为
,B的结构简式为![]() ;D的结构简式为
;D的结构简式为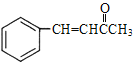 ,D中官能团为碳碳双键和羰基,D→高分子E为加聚反应,E的结构简式为
,D中官能团为碳碳双键和羰基,D→高分子E为加聚反应,E的结构简式为 。A与浓硝酸、浓硫酸加热发生硝化反应生成F,根据F的分子式以及I中苯环上两个取代基处于对位,F的结构简式为
。A与浓硝酸、浓硫酸加热发生硝化反应生成F,根据F的分子式以及I中苯环上两个取代基处于对位,F的结构简式为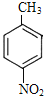 ;根据题给已知,F与Fe/HCl(aq)发生还原反应生成G,G的结构简式为
;根据题给已知,F与Fe/HCl(aq)发生还原反应生成G,G的结构简式为![]() ,流程中G→H(C9H11NO)→I和I的结构简式,H的结构简式为
,流程中G→H(C9H11NO)→I和I的结构简式,H的结构简式为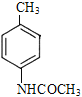 。
。
详解:(1)A属于芳香烃,A与Cl2光照发生侧链上取代反应生成B,B的分子式为C7H6Cl2,A的结构简式为![]() ,名称为甲苯。根据K的结构简式,K含有的官能团的名称是羧基、氨基、溴原子。
,名称为甲苯。根据K的结构简式,K含有的官能团的名称是羧基、氨基、溴原子。
(2)反应⑦为G中-NH2与(CH3CO)2O反应生成-NHCOCH3,反应⑧为KMnO4/H+将H中苯环上的-CH3氧化成-COOH,对比I和J的结构简式,I→J为苯环上的溴代反应,J→K为酰胺基水解成-NH2,由此可见,反应⑦的作用是:保护氨基,防止氨基被氧化。反应⑩为酰胺基的水解反应,反应类型为取代反应。
(3)反应②为B的水解反应,反应的化学方程式为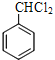 +2NaOH
+2NaOH![]()
![]() +2NaCl+H2O。
+2NaCl+H2O。
(4)D的结构简式为 ,除-CH3碳原子为sp3杂化,其余碳原子都为sp2杂化,联想苯、乙烯和HCHO的结构,根据单键可以旋转,D分子中最多有19个原子共面(6个苯环碳原子、2个双键碳原子、羰基碳原子以及与它们直接相连的原子,-CH3中只有1个H在该平面上,
,除-CH3碳原子为sp3杂化,其余碳原子都为sp2杂化,联想苯、乙烯和HCHO的结构,根据单键可以旋转,D分子中最多有19个原子共面(6个苯环碳原子、2个双键碳原子、羰基碳原子以及与它们直接相连的原子,-CH3中只有1个H在该平面上, 。
。
(5)D的结构简式为 ,D的分子式为C10H10O,1molD与1molH2发生加成反应所得产物的分子式为C10H12O,该加成产物的同分异构体的不饱和度为5,该加成产物的同分异构体能与FeCl3发生显色反应,该加成产物的同分异构体中含酚羟基,分子中只存在一个环不含其它环状结构,苯环上有四种不同化学环境的H原子,苯环上有两个取代基且两个取代在邻位或间位,两个取代基有下列情况:①-OH和-CH=CHCH2CH3、②-OH和-CH2CH=CHCH3、③-OH和-CH2CH2CH=CH2、④-OH和
,D的分子式为C10H10O,1molD与1molH2发生加成反应所得产物的分子式为C10H12O,该加成产物的同分异构体的不饱和度为5,该加成产物的同分异构体能与FeCl3发生显色反应,该加成产物的同分异构体中含酚羟基,分子中只存在一个环不含其它环状结构,苯环上有四种不同化学环境的H原子,苯环上有两个取代基且两个取代在邻位或间位,两个取代基有下列情况:①-OH和-CH=CHCH2CH3、②-OH和-CH2CH=CHCH3、③-OH和-CH2CH2CH=CH2、④-OH和![]() 、⑤-OH和
、⑤-OH和![]() 、⑥-OH和
、⑥-OH和![]() 、⑦-OH和
、⑦-OH和![]() 、⑧-OH和
、⑧-OH和![]() ,符合条件的同分异构体共2
,符合条件的同分异构体共2![]() 8=16种。
8=16种。
(6) 与H2发生加成反应生成
与H2发生加成反应生成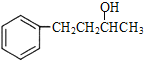 ,对比
,对比![]() 与
与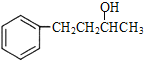 的结构简式,碳干骨架没有变化,官能团从一个羟基变为两个碳碳双键,根据课本有机物之间的相互转化,合成步骤为:
的结构简式,碳干骨架没有变化,官能团从一个羟基变为两个碳碳双键,根据课本有机物之间的相互转化,合成步骤为: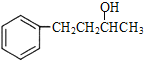 发生消去反应生成
发生消去反应生成![]() ,
,![]() 与Br2发生加成反应生成
与Br2发生加成反应生成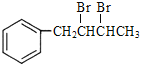 ,
,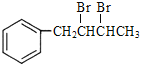 发生消去反应生成
发生消去反应生成![]() 。补充的合成路线为:
。补充的合成路线为:![]()
![]()
![]()
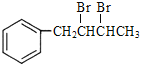
![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
A. 1 molKClO3参加反应有1mole- 转移 B. ClO2是氧化产物
C. H2C2O4在反应中被还原 D. KClO3在反应中得到电子,作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
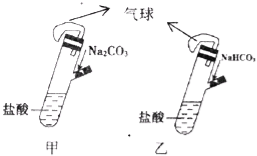
A. 甲装置的气球膨胀速率大
B. 若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C. 若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D. 最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,以任意比例混合的氧气和二氧化碳混合物22.4 L,所含的分子数为NA
B. 标准状况下,1 L汽油(分子式为C8H18)完全燃烧后,所生成气体产物的分子数为8NA/22.4
C. 标准状况下,1 L SO3所含分子数为NA/22.4
D. 标准状况下,以任意比混合的氢气和一氧化碳气体共8.96 L,在足量氧气中充分燃烧时消耗氧气的分子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,相关信息如下:
元素 | 相关信息 |
X | 其单质为固体,常作电极材料 |
Y | 原子核外有6种不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(答题时,X、Y、Z、W、R、M用所对应的元素符号表示):
(1)X的单质与Z的单质反应的产物为_____________。(填化学式)。
(2)Z、W相比,第一电离能较大的是_____________,M2+的核外电子排布式为_____________。
(3)M2Z的熔点比M2W的_____________(填“高”或“低”),请解释原因______________________。
(4)Y和Z形成的化合物YZ2的VSEPR模型为__________,其中Y原子的杂化轨道类型为____________;N3-和YZ2互为等电子体,则N3-的结构式为_____________。
(5)MRW2的晶胞如图所示,晶胞参数a=0.524nm,c=1.032nm;MRW2的晶胞中每个M原子与_________个W原子相连,晶体密度ρ=________g·cm-3(只要求列算式,不必计算出数值,NA=6.02×1023mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2FeSO4![]() Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
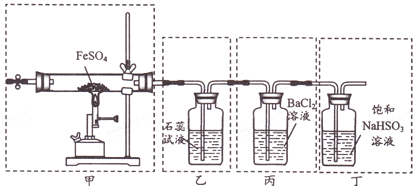
A. 用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B. 用装置乙可检验分解产生的SO2,现象是石蕊试液先变红后褪色
C. 用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D. 用装置丁可吸收尾气,避免污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铅蓄电池放电时负极质量减轻,充电时阳极质量增加
B. 同温下,0.1 mol·L-1醋酸溶液pH=a,0.01 mol·L-1醋酸溶液pH=b,则a+1<b
C. 钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行防护
D. 一定条件下反应N2+3H2![]() 2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金),为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误: ( )
A.硫酸铜溶液
B.盐酸
C.稀硝酸
D.硝酸银溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com