
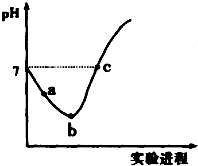
 �����£���Cl2����ͨ��ˮ�������ͣ�Ȼ�������ñ�����ˮ�еμ�0.1mol•L-1��NaOH��Һ������ʵ���������Һ��pH�仯������ͼ��ʾ������������ȷ���ǣ�������
�����£���Cl2����ͨ��ˮ�������ͣ�Ȼ�������ñ�����ˮ�еμ�0.1mol•L-1��NaOH��Һ������ʵ���������Һ��pH�仯������ͼ��ʾ������������ȷ���ǣ�������| A�� | ��a����ʾ��Һ��ͨ��SO2����Һ�����Ժ�Ư���Ծ���ǿ | |
| B�� | b����ʾ����Һ�У�c��H+����c��Cl-����c��ClO-����c��HClO�� | |
| C�� | ��a�㵽b��Ĺ����У���Һ��$\frac{c��{H}^{+}��}{c��Cl{O}^{-}��}$��С | |
| D�� | c ����ʾ��Һ�У�c��Na+��=2c��ClO-��+c��HClO�� |
���� �������̷����ķ�ӦΪCl2+H2O�THCl+HClO��HCl+NaOH�TNaCl+H2O��HClO+NaOH�TNaClO+H2O��������Һ������Խ�ϵ���غ�������غ�������
A���������������ԣ��ܽ�������������Ϊ���ᣬ��������ԭΪ���
B��b ����ʾ��Һ�з�����Ӧ��Cl2+H2O=H++Cl-+HClO��HClOΪ������ʣ����ֵ��룬��Һ�д��ڵ������У�H+��Cl-��ClO-��OH-��H2O��HClO��Cl2��
C����a�㵽b��Ĺ������������ܽ�ƽ��Cl2+H2O?H++Cl-+HClO���ҽ��еĹ��̣���������ǿ��������Ũ��������
D��������Һ������Խ�ϵ���غ�������غ������
��� �⣺A���������������ԣ��ܽ�������������Ϊ���ᣬ��������ԭΪ���ᣬ���õ�����Һ���پ���Ư���ԣ���A����
B��b ����ʾ��Һ�з�����Ӧ��Cl2+H2O=H++Cl-+HClO��HClOΪ������ʣ����ֵ��룬��Һ�д��ڵ������У�H+��Cl-��ClO-��OH-��H2O��HClO��Cl2����Һ�У�c��H+����c��Cl-����c��HClO����c��ClO-������B����
C����a�㵽b��Ĺ������������ܽ�ƽ��Cl2+H2O?H++Cl-+HClO���ҽ��еĹ��̣���������ǿ��������Ũ����������Һ��$\frac{c��{H}^{+}��}{c��Cl{O}^{-}��}$����C����
D��c����Һ�����ԣ���c��H+��=c��OH-�������ݵ���غ��c��H+��+c��Na+��=c��Cl-��+c��Cl0-��+c��OH-��������c��Na+��=c��Cl-��+c��ClO-�������������غ��c��Cl-��=c��ClO-��+c��HClO��������c��Na+��=c��HClO��+2c��ClO-������D��ȷ��
��ѡD��
���� �����ۺϿ������������ʣ�������ѧ���ķ��������Ŀ��飬ע��������Һ�е����ʼ��������ǽⱾ��ؼ������������غ��c��Cl-��=c��ClO-��+c��HClO����Ϊ�״��㣬�Ѷ��еȣ�


 ������ÿ�ʱ�Ż���ҵϵ�д�
������ÿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-1 068 kJ/mol | |
| B�� | �����백���Ƶ������������ˮ������뷽��ʽ��N2H4+H2O�TN2H5++OH- | |
| C�� | �����缫����KOH��ҺΪ�������Һ����--����ȼ�ϵ�أ��ŵ�ʱ�ĸ�����Ӧʽ��N2H4-4e-+4OH-=N2+4H2O | |
| D�� | �����缫����KOH��ҺΪ�������Һ����--����ȼ�ϵ�أ�����һ��ʱ���KOH��Һ��pH������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����������ʵ���֮��Ϊ1��1��Br2�ӳ�ʱ�����ò����У�������
�����������ʵ���֮��Ϊ1��1��Br2�ӳ�ʱ�����ò����У�������| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 L SO3�к�����ԭ����ĿΪ3.0NA | |
| B�� | ���³�ѹ�£�12.0 gNaHSO4�к�����������Ϊ0.3NA | |
| C�� | ij�ܱ�����ʢ��0.1 mol N2��0.3 mol H2����һ�������³�ַ�Ӧ��ת�Ƶ��ӵ���ĿΪ0.6NA | |
| D�� | ��1 L 0.1 mol•L-1̼������Һ�У���������������0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӱ뾶�Ĵ�С˳��Ϊ��rX��rY��rZ��rW��rQ | |
| B�� | Z��Q�γɵĻ�����Ϊ���ӻ����� | |
| C�� | ��������Ԫ��Z��Ԫ��W�γɵĻ������ˮ��Һ | |
| D�� | Ԫ��W������������Ӧ��ˮ��������Ա�Q��ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ҵ����N2��H2 �ϳ�NH3��N2��g��+3H2��g���T2NH3��g����H��0���������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺
��ҵ����N2��H2 �ϳ�NH3��N2��g��+3H2��g���T2NH3��g����H��0���������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺ | 1Сʱ | 2 Сʱ | 3Сʱ | 4Сʱ |
| T3 | 30% | 50% | 80% | 80% |
| T4 | 35% | 60% | a | b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | n��CH4��/mol | n��H2O��/mol | n��CO��/mol | n��H2��/mol |
| t1 | 0.18 | 0.38 | 0.22 | 0.66 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ӵ������ԣ�Z��X | |
| B�� | ��̬�⻯����ȶ��ԣ�M��Y | |
| C�� | �����Ӱ뾶�ɴ�С��˳���ǣ�M��Y��Z | |
| D�� | ��X2M��Z2M����Һ�У�ˮ�ĵ���̶ȣ�ǰ�ߴ��ں��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
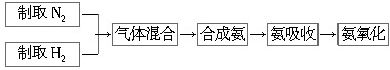
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com