
镁是海水中含量较多的金属元素,单质镁、镁合金以及镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(s) △H1=—74.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=—64.4kJ·mol-1
Mg2Ni(s)+2 MgH2(s)=2Mg(s)+ Mg2NiH4(s) △H3
则△H3=____________ kJ·mol-1
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁晶体脱水是关键的工艺之一。一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2·6H20转化为MgCl2·NH4Cl·nNH3,然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为_________________________;用惰性电极电解熔融氯化镁,阴极的电极反应式为______________________________
(3)储氢材料Mg(AlH4)2在110℃—200℃的反应为: Mg(AlH4)2=MgH2+2Al+3H2↑,每生成27gAl转移电子的物质的量为__________
(4)镁的一种化合物氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等。为了确定实验室制备的Mg(ClO3)2•6H2O的纯度,做如下试验:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.
产品中Mg(ClO3)2•6H2O的纯度为__________(用百分号表示,精确到小数点后一位)
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为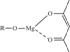 ,它可以发生如下反应:
,它可以发生如下反应:
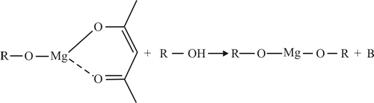
ROH与B的核磁共振氢谱如下图:
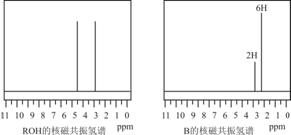
ROH由C、H、O、F四种元素组成的含氟化合物,分子中只有一个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为_______________;B的结构简式为_________________
【知识点】反应热和焓变、电解原理、制备实验方案的设计
【答案解析】(1)84.6 (2)MgCl2•NH4Cl•nNH3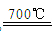 MgCl2+(n+1)NH3↑+HCl↑
MgCl2+(n+1)NH3↑+HCl↑
Mg2++2e-=Mg (3)3mol (4)78.3% (5)(CF3)2CHOH , 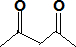
解析::(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3=-64.4KJ/mol-2×(-74.5KJ/mol)=84.6KJ/mol,则△H3=84.6KJ/mol,
(2)MgCl2•NH4Cl•nNH3在700℃脱氨得到无水氯化镁,反应的化学方程式MgCl2•NH4Cl•nNH3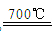 MgCl2+(n+1)NH3↑+HCl↑;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁,电极反应为:Mg2++2e-=Mg;
MgCl2+(n+1)NH3↑+HCl↑;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁,电极反应为:Mg2++2e-=Mg;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol;
(4)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,氯酸根离子的物质的量为:1/6×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:(1/12 ×0.011×299g/mol)×10× 1/35×100%=78.3%
(5)ROH由C、H、O、F四种元素组成的含氟化合物,分子中只有一个氧原子,核磁氢谱表示含有2个氢原子,所有氟原子化学环境相同,说明在一个碳原子上,相对分子质量为168,则ROH的结构简式为(CF3)2CHOH;依据反应过程化学键断裂位置分析判断生成产物B的结构简式为 ,
,
【思路点拨】本题考查对常见金属元素及其化合物主要性质的掌握,主要是氧化还原反应,电子转移计算,滴定实验步骤和含量的计算分析,有机物结构和反应过程分析是解题关键,题目难度中等。


科目:高中化学 来源: 题型:
关于下列物质的变化过程:H2→H2O;CO→CO2;C→CO2,说法不正确的是 ( )
A. 都能通过化合反应实现 B.都能通过置换反应实现
C.都能通过和单质反应实现 D.变化前后都有元素的化合价的改变
查看答案和解析>>
科目:高中化学 来源: 题型:
对于下列几种化学符号,有关说法正确的是( )
①N ②Na+ ③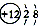 ④P2O5 ⑤KClO3.
④P2O5 ⑤KClO3.
A.表示物质组成的化学式有①④⑤ B.表示阳离子的有②③
C.④中数字“5”表示五氧化二磷中有5个氧原子 D.⑤中各元素的质量比为1:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
人体摄入锌不足会引起多种疾病,缺锌患者可在医生指导下通过服用葡萄糖酸锌口服液来补锌,已知葡萄糖酸锌的化学式为:C12H22OxZn,其相对分子质量为455,求:
(1)葡萄糖酸锌由 种元素组成.
(2)葡萄糖酸锌化学式中x= .
(3)葡萄糖酸锌中锌元素的质量分数(简单写出计算过程,结果保留到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学用沉淀法测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下。①可以使用MgCl2溶液作沉淀剂,使OH-转化为氢氧化镁沉淀 ②检验CO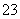 是否完全沉淀的操作方法是取上层清液,向其中继续滴加沉淀剂溶液,观察是否有沉淀继续生成 ③用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是能提高实验结果的准确度 ④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO
是否完全沉淀的操作方法是取上层清液,向其中继续滴加沉淀剂溶液,观察是否有沉淀继续生成 ③用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是能提高实验结果的准确度 ④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO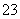 能100%转化为沉淀。其中正确的叙述是( )
能100%转化为沉淀。其中正确的叙述是( )
A.①② B.②③ C.①③④ D.都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置或操作正确的是 ( )
|
|
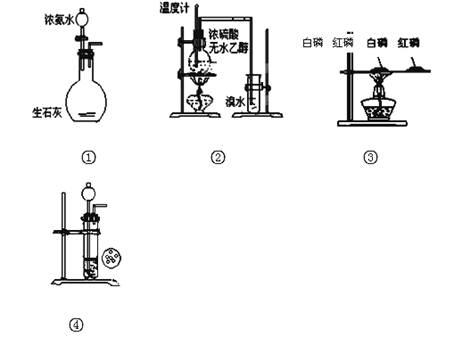
A.实验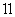 制取氨气
制取氨气
B.实验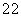 溴水褪色证明了乙烯可以与溴发生加成反应
溴水褪色证明了乙烯可以与溴发生加成反应
C.实验 比较红磷和白磷的着火点
比较红磷和白磷的着火点
D.实验 用CaC2和饱和食盐水反应制取C2H2
用CaC2和饱和食盐水反应制取C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:
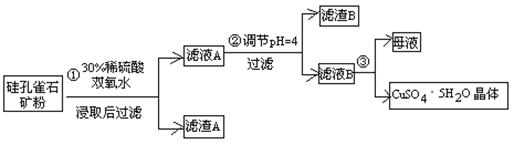
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
由上表可知:当溶液pH=4时,不能完全除去的离子是________。
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
 Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。[]
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。[]
 Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)R2Cu
(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________ 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在三个2 L恒容的容器中,分别发生反应A(g)+3B(g)  2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。
2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。
反应前各物质的物质的量/mol
A B C
甲 1 3 0
乙 0 0 2
丙 1.5 4.5 1
下列说法正确的是 ( )
A.乙中5 min内C的反应速率为0.16 mol·L-1·min-1
B.达到平衡时,丙中A的浓度是甲中的2倍
C.丙中反应的平衡常数大于甲中反应的平衡常数
D.达到平衡时,甲乙两容器中C的物质的量百分含量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以硫酸为电解质的燃料电池发电。电池负极反应为 ( )
A H2+2OH--2e-=2H2O B O2+4H++4e-=2H2O
C H2-2e-=2H+ D O2+2H2O+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com