
| A. | Na2O、MgO、Al2O3都是碱性氧化物 | |
| B. | 硬铝、黄铜、钢铁都属于合金 | |
| C. | 纤维素、硝化纤维、纤维二糖都是高分子 | |
| D. | 蔗糖、乙醇、液氯都是非电解质 |
分析 A.碱性氧化物是指能和酸反应生成盐和水的氧化物;
B.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;
C.纤维二糖不是高分子化合物,纤维二糖是纤维素的基本结构单元;
D.单质既不是电解质也不是非电解质.
解答 解:A.Al2O3与强酸、强碱都能反应生成盐和水,属于两性氧化物,不是碱性氧化物,故A错误;
B.硬铝是由Al、Cu、Mg等金属组成的、黄铜是由Cu和Zn组成的,钢铁是由Fe和碳等组成的,它们都具有金属特性属于合金,故B正确;
C.纤维二糖不是高分子化合物,纤维二糖是纤维素的基本结构单元,纤维素、硝化纤维属于高分子化合物,故C错误;
D.液氯是单质,单质既不是电解质也不是非电解质,蔗糖、乙醇都是非电解质,故D错误.
故选B.
点评 本题考查了物质的量分类,涉及碱性氧化物和两性氧化物、合金、高分子化合物、非电解质,题目难度不大,明确有关的概念是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
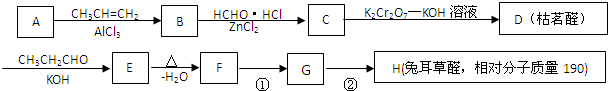
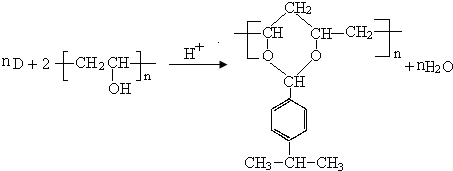
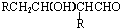 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$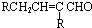
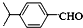 .
.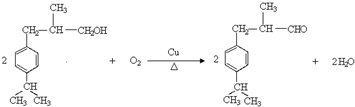 .
.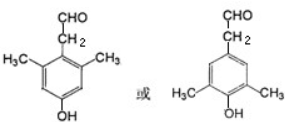 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
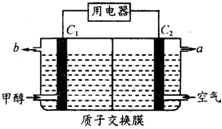 燃料电池的能量利用率比内燃机高,已应用于汽车中.如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )
燃料电池的能量利用率比内燃机高,已应用于汽车中.如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )| A. | b口放出气体为CO2 | |
| B. | 质子将由C1电极区经交换膜向C2电极区运动 | |
| C. | 用该电池电解精制铜,当消耗1mol甲醇时,可溶解粗铜中3 molCu | |
| D. | 电池总反应的产物与甲醇燃烧产物一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在t1、t3℃时,NaCl和MgSO4的溶解度相等 | |
| B. | t2~t3℃,MgSO4的溶解度随温度升高而增大 | |
| C. | 在t2℃时,MgSO4饱和溶液的溶质质量分数最大 | |
| D. | 把MgSO4饱和溶液的温度从t2℃升至t3℃时,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木糖醇与核糖(C3H10O3)互为同分异构体 | |
| B. | 木糖醇与甘油(CH2OHCHOHCH2OH)互为同系物 | |
| C. | 木糖醇可以与乙酸发生酯化反应 | |
| D. | 木糖醇与葡萄一样是一种单糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物就是仅有碳、氢两种元素组成的化合物 | |
| B. | 有机物都是非电解质,不能导电 | |
| C. | 组成符合CnHn的有机物分子一定互为同系物 | |
| D. | 含有醛基(-CHO)的有机物不一定是醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内有1mol A生成,有1molC消耗 | |
| B. | 混合气体的密度不变 | |
| C. | A的消耗速率与D的消耗速率相同 | |
| D. | B物质的相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com