
| A. | 1 mol/L | B. | 1.5 mol/L | C. | 2mol/L | D. | 3 mol/L |
科目:高中化学 来源: 题型:选择题
| A. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 实验时,将水倒入浓硫酸中配制稀硫酸 | |
| D. | 进入煤矿井时,用火把照明 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol•L-1氯酸钠溶液 | B. | 3 mol•L-1氯化钙溶液 | ||
| C. | 3 mol•L-1氯化钾溶液 | D. | 3 mol•L-1氯化镁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )| A. | m+n+a | B. | m+2-a | C. | 2n+3m-a | D. | m+2n+2-a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
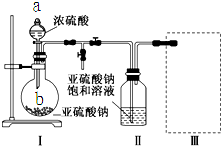 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验: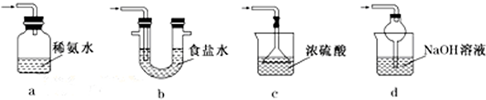
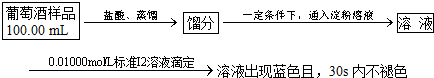
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com