
| A. | 镀锡的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| B. | 在空气中,光亮的银器表面逐渐变暗 | |
| C. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 | |
| D. | 为保护海轮的船壳,常在船壳上镶入锌块 |
分析 A.镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀;
B.金属银在空气中发生化学腐蚀生成氧化银而变黑;
C.干燥的土壤中没有电解质溶液;
D.Zn、Fe形成原电池时,Fe作正极被保护.
解答 解:A.镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀,与电化学腐蚀有关,故A不选;
B.金属银在空气中能够在空气中被氧化生成黑色的硫化银而变黑,此过程属于普通化学腐蚀,与电化学腐蚀无关,故B选;
C.干燥的土壤中没有电解质溶液,不能形成原电池反应,埋在潮湿土壤里易形成原电池反应,所以埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀,与电化学腐蚀有关,故C不选;
D.Zn、Fe形成原电池时,Fe作正极被保护,所以为保护海轮的船壳,常在船壳上镶入锌块,与电化学腐蚀有关,故D不选;
故选B.
点评 本题考查了化学腐蚀和电化腐蚀的实质分析,原电池的形成条件是解题关键,题目较简单,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 体积相同,浓度都为 0.1 mol•L-1的盐酸和醋酸分别与体积相同 2 mol•L-1的NaOH溶液反应,两者速率相同 | |
| B. | 用锌和稀硫酸反应制取氢气时,加入少量硫酸铜固体会使生成氢气的速率加快 | |
| C. | Mg粉和Al粉分别与0.1 mol•L-1的NaOH溶液反应,Mg粉反应速率快 | |
| D. | 相同温度下,大理石块与大理石粉分别与盐酸反应,大理石块的反应速率慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 冰镇的啤酒打开后泛起泡沫 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
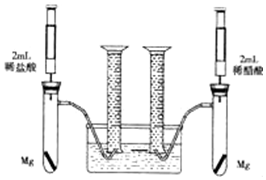 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融状态下,1molNa2O2 完全电离出的离子数目为 3NA | |
| B. | 将 CO2 通过 Na2O2 使固体质量增加 mg,反应中转移的电子数 m NA/14 | |
| C. | 在标准状况下,22.4LCH4与 18 gH2O 所含有的电子数均为 10NA | |
| D. | 含 1mol Cl-的 NH4Cl 溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+的数目为NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该溶液一定有CO32- | |
| B. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| D. | 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com